Giải SBT Hóa 10 Bài 3. Nguyên tố hóa học có đáp án
Giải SBT Hóa 10 Bài 3. Nguyên tố hóa học có đáp án
-
66 lượt thi
-
16 câu hỏi
-
40 phút
Danh sách câu hỏi
Câu 1:
21/07/2024Cho các phát biểu sau:
(1) Trong một nguyên tử luôn có số proton bằng số electron và bằng số đơn vị điện tích hạt nhân.
(2) Tổng số proton và số electron trong một hạt nhân được gọi là số khối.
(3) Số khối là khối lượng tuyệt đối của nguyên tử.
(4) Số proton bằng số đơn vị điện tích hạt nhân.
(5) Đồng vị là các nguyên tố có cùng số proton nhưng khác nhau về số neutron.
Số phát biểu không đúng là:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: C
Các phát biểu (2); (3); (5) sai.
(2) sai vì tổng số proton và số neutron trong một hạt nhân được gọi là số khối.
(3) sai vì số khối là khối lượng tương đối của nguyên tử, khối lượng tuyệt đối là tổng khối lượng của proton, neutron và electron.
(5) sai vì đồng vị là những nguyên tử có cùng số proton nhưng khác nhau về số neutron.
Câu 2:
13/07/2024Cho các phát biểu sau, phát biểu nào đúng về đồng vị?
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: D
Những nguyên tử có cùng số hạt proton nhưng khác nhau về số hạt neutron là đồng vị của nhau.
Câu 3:
20/07/2024Có những phát biểu sau đây về các đồng vị của một nguyên tố hóa học:
(1) Các đồng vị có tính chất hóa học giống nhau.
(2) Các đồng vị có tính chất vật lí khác nhau.
(3) Các đồng vị có cùng số electron ở vỏ nguyên tử.
(4) Các đồng vị có cùng số proton nhưng khác nhau về số khối.
Trong các phát biểu trên, số phát biểu đúng là
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: D
Cả 4 phát biểu đều đúng.
Câu 4:
22/07/2024 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: A
Số khối (A) = 56 + 81 = 137.
Số hiệu nguyên tử (Z) = số electron = 56.
Vậy kí hiệu nguyên tử: \[{}_{56}^{137}A\]
Câu 5:
20/07/2024Câu 6:
16/07/2024Có 3 nguyên tử: \[{}_6^{12}X,{}_7^{14}Y,{}_6^{14}Z\]. Những nguyên tử nào là đồng vị của một nguyên tố?
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: C
X và Z có cùng số proton (là 6) nên là đồng vị của một nguyên tố.
Câu 7:
16/07/2024 Xem đáp án
Xem đáp án
Lời giải:
Không có nguyên tử boron nào có khối lượng chính xác là 10,81 amu do 10,81 là nguyên tử khối trung bình của các đồng vị boron trong tự nhiên.
Câu 9:
20/07/2024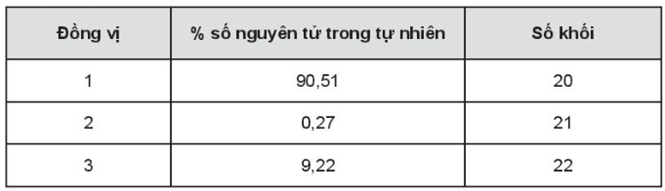
Tính nguyên tử khối trung bình của nguyên tố X.
 Xem đáp án
Xem đáp án
Lời giải:
Nguyên tử khối trung bình của nguyên tố X:
\[{\overline A _X} = \frac{{90,51.20 + 0,27.21 + 9,22.22}}{{100}} = 20,1871\]
Câu 11:
21/07/2024 Xem đáp án
Xem đáp án
Lời giải:
Số proton = số electron = Z = 30.
Số neutron = số khối (A) – số hiệu nguyên tử (Z) = 65 – 30 = 35.
Câu 12:
22/07/2024Nguyên tử Mg có ba đồng vị ứng với thành phần phần trăm về số nguyên tử như sau:
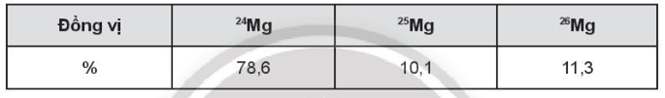
Giả sử trong hỗn hợp nói trên có 50 nguyên tử \[{}^{25}Mg\], số nguyên tử tương ứng của hai đồng vị \[{}^{24}Mg\]và \[{}^{26}Mg\]lần lượt là:
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: A
Giả sử trong hỗn hợp nói trên có 50 nguyên tử \[{}^{25}Mg\], số nguyên tử tương ứng của hai đồng vị còn lại là:
+ Số nguyên tử 24Mg: \[\frac{{50}}{{10,1}}.78,6 = 389\] nguyên tử.
+ Số nguyên tử 26Mg: \[\frac{{50}}{{10,1}}.11,3 = 56\] nguyên tử.
Câu 13:
14/07/2024Hãy so sánh:
Số lượng hợp chất và số lượng nguyên tố.
 Xem đáp án
Xem đáp án
Lời giải:
Số lượng hợp chất lớn hơn số lượng nguyên tố vì hợp chất là sự kết hợp của 2 hay nhiều nguyên tố.
Câu 14:
13/07/2024 Xem đáp án
Xem đáp án
Lời giải
Số lượng nguyên tố ít hơn số lượng đồng vị vì hầu hết các nguyên tố hóa học đều có nhiều đồng vị.
Câu 15:
23/07/2024Oxide của kim loại M (M2O) được ứng dụng rất nhiều trong ngành hóa chất như sản xuất xi măng, sản xuất phân bón, … Trong sản xuất phân bón, chúng ta thường thấy M2O có màu trắng, tan nhiều trong nước và là thành phần không thể thiếu cho mọi loại cây trồng. Tổng số hạt cơ bản trong phân tử X có công thức M2O là 140, trong phân tử X có tổng số hạt mang điện nhiều hơn số hạt không mang điện là 44. Xác định công thức phân tử của M2O.
 Xem đáp án
Xem đáp án
Lời giải:
Trong X có 2 nguyên tử M và 1 nguyên tử O.
Nguyên tử O có pO = 8 và nO = 8
Tổng số hạt cơ bản trong phân tử X có công thức M2O là 140 nên:
4pM + 2nM + 2pO + nO = 140 hay 4pM + 2nM = 116 (1)
Trong phân tử X có tổng số hạt mang điện nhiều hơn số hạt không mang điện là 44 nên:
(4pM + 2pO) – ( 2nM + nO) = 44 hay 4pM – 2nM = 36 (2)
Từ (1) và (2) có pM = 19 và nM = 20.
Vậy M là K (potassium); X là K2O.
Câu 16:
18/07/2024 Xem đáp án
Xem đáp án
Lời giải:
Kí hiệu số đơn vị điện tích hạt nhân X, Y lần lượt là ZX; ZY; số neutron (hạt không mang điện) của X và Y lần lượt là NX và NY.
Mỗi phân tử XY2 có tổng các hạt proton, neutron, electron bằng 178 nên:
2ZX + 4ZY + NX + 2NY = 178 (1)
Trong XY2, số hạt mang điện nhiều hơn số hạt không mang điện là 54 nên:
2ZX + 4ZY – (NX + 2NY) = 54 (2)
Từ (1) và (2) ta có: 2ZX + 4ZY = 116 (3)
Lại có trong XY2 số hạt mang điện của X ít hơn số hạt mang điện của Y là 12, nên:
2ZX + 12 = 4ZY (4)
Từ (3) và (4) ta có: ZX = 26; ZY = 16.
Vậy X là sắt (iron, Fe); Y là lưu huỳnh (sulfur, S).