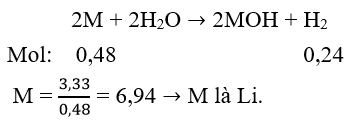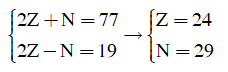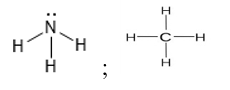Đề thi Hóa học 10 Giữa học kì 1 năm 2020 - 2021 có đáp án
Đề thi Hóa học 10 Giữa học kì 1 năm 2020 - 2021 có đáp án (Đề 2)
-
502 lượt thi
-
29 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
05/07/2024Trong bảng tuần hoàn các nguyên tố được sắp xếp theo nguyên tắc nào?
 Xem đáp án
Xem đáp án
Đáp án D
Câu 3:
06/07/2024Cho cấu hình electron của Ca là [Ar]. Ca thuộc nguyên tố nào?
 Xem đáp án
Xem đáp án
Đáp án A
Theo trật tự phân mức năng lượng, electron cuối cùng được điền vào phân lớp s.
Câu 4:
21/07/2024Nguyên tử nguyên tố X có tổng số hạt bằng 82, hạt mang điện nhiều hơn hạt không mang điện là 22 hạt. Số khối A của nguyên tử X là
 Xem đáp án
Xem đáp án
Đáp án C
Gọi số hạt proton, nơtron và electron trong X lần lượt là p, n và e.
Tổng số hạt proton, nơtron và electron trong 1 nguyên tử nguyên tố X là 82:
p + e + n = 82 hay 2p + n = 82 (do p = e) (1)
Số hạt mang điện (p và e) nhiều hơn số hạt không mang điện (n) là 22 hạt
(p+e) – n = 22 hay 2p – n = 22 (2)
Giải (1), (2) ta có p = e = 26; n =30
Số khối của X là A= Z + N = p + n = 56.
Câu 5:
03/07/2024Nguyên tử của nguyên tố R có 3 lớp e, lớp ngoài cùng có 3e. Vậy số hiệu nguyên tử của nguyên tố R là
 Xem đáp án
Xem đáp án
Đáp án D
Cấu hình của R là
Vậy số hiệu nguyên tử của R là 13.
Câu 6:
18/07/2024Hợp chất vô cơ T có công thức phân tử XY2. Tổng số các hạt trong phân tử T là 66, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 22 hạt. Số khối của Y nhiều hơn X là 4. Số hạt trong Y nhiều hơn số hạt trong X là 6 hạt. Công thức phân tử của T là
 Xem đáp án
Xem đáp án
Đáp án D
Gọi số hạt proton, nơtron và electron của nguyên tử X là: và của nguyên tử Y là .
Tổng số hạt proton, nơtron và electron của nguyên tử là 66
+ + + 2.( + + ) = 66 hay 2 + + 4 +2 = 66 (1)
( = và = ).
Trong T số hạt mang điện nhiều hơn số hạt không mang điện là 22 nên:
+ + 2 + 2ey – - 2 = 22 => 2 + 4 - - 2 = 22 (2)
Số khối của Y nhiều hơn X là 4
+ - ( + ) = 4 (3)
Số hạt trong Y nhiều hơn số hạt trong X là 6 hạt
+ + – ( + + ) = 6 hay 2 + – (2 + ) = 6 (4)
Từ (1), (2), (3), (4) ta có: = 6 (C) và = 8 (O).
Câu 7:
18/07/2024Số nguyên tố thuộc chu kỳ 3 là
 Xem đáp án
Xem đáp án
Đáp án A
Chu kì 3 là chu kì nhỏ, có 8 nguyên tố trong 1 chu kì.
Câu 8:
20/07/2024Cho cấu hình electron của Mn [Ar]. Mn thuộc nguyên tố nào?
 Xem đáp án
Xem đáp án
Đáp án C
Nguyên tử Mn có electron cuối cùng được điền vào phân lớp d theo trật tự phân mức năng lượng nên là nguyên tố d.
Câu 9:
04/07/2024Cation R+ có cấu hình electron phân lớp ngoài cùng là . Vị trí của R trong bảng tuần hoàn là
 Xem đáp án
Xem đáp án
Đáp án C
Cấu hình electron của R+:
=> Cấu hình electron của R: [Ar]
R có 19 electron: thuộc ô 19,
R có 4 lớp electron: thuộc chu kì 4,
R có 1 electron lớp ngoài cùng, R là nguyên tố s: nhóm IA.
Câu 10:
03/07/2024Nguyên tố hóa học X có Z = 20. Điều khẳng định nào sau đây là sai?
 Xem đáp án
Xem đáp án
Đáp án D
Cấu hình electron nguyên tử X: [Ar]
X có 2 e lớp ngoài cùng nên có tính kim loại
Câu 11:
21/07/2024Nguyên tố R có hóa trị cao nhất trong oxit gấp 3 lần hóa trị trong hợp chất với hiđro. Hóa trị của R trong hợp chất với hiđro là
 Xem đáp án
Xem đáp án
Đáp án D
Gọi hóa trị cao nhất của R trong oxit là m, hóa trị trong hợp chất với hiđro là n. Ta có: m + n = 8.
Theo bài: m = 3n. Từ đây tìm được m = 6; n = 2.
=> Hóa trị của R trong hợp chất khí với H là 2.
Câu 12:
03/07/2024Khi cho 3,33 g một kim loại thuộc phân nhóm chính nhóm I tác dụng với nước thì có 0,48 g khí thoát ra. Vậy kim loại trên là
 Xem đáp án
Xem đáp án
Đáp án A
Phương trình phản ứng
Câu 13:
17/07/2024Oxit cao nhất của một nguyên tố ứng với công thức. Hợp chất của nó với hiđro là một chất có thành phần không đổi với R chiếm 82,35% và H chiếm 17,65% về khối lượng. Nguyên tố R là
 Xem đáp án
Xem đáp án
Đáp án A
Nguyên tố có oxit cao nhất là → R thuộc nhóm VA.
→ Hợp chất với hiđro:
Câu 14:
20/07/2024Số proton và nơtron trong hạt nhân nguyên tử lần lượt là
 Xem đáp án
Xem đáp án
Đáp án A
p = z = 92.
n = A – z = 235 – 92 = 143.
Câu 15:
03/07/2024Nguyên tử X có tổng số hạt cơ bản là 77, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 19. Cho các phát biểu sau:
(a) Nguyên tử X có số khối là 53.
(b) Nguyên tử X có 7 electron s.
(c) Lớp M của nguyên tử X có 13 electron.
(d) X là nguyên tố s.
(e) X là nguyên tố kim loại.
(f) X có 4 lớp electron.
Trong các phát biểu trên, số phát biểu đúng là
 Xem đáp án
Xem đáp án
Đáp án A
Đặt số proton = số electron = Z; số nơtron là N. Ta có:
(a) A = Z + N = 24 + 29 = 53 => Đúng
(b) X: có 2+2 +2 + 1 = 7 electron s => Đúng
(c) Lớp M (lớp 3) có 2 + 6 + 5 = 13e => Đúng
(d) Electron cuối cùng được điền vào phân lớp d nên X là nguyên tố d =>d Sai
(e) Đúng
(f) Đúng.
Câu 16:
20/07/2024Dãy những chất nào sau đây trong phân tử chỉ chứa liên kết đơn?
 Xem đáp án
Xem đáp án
Đáp án A
H – O – H;
Câu 17:
22/07/2024Trong một nhóm A của bảng tuần hoàn, đi từ trên xuống dưới thì điều khẳng định đúng là
 Xem đáp án
Xem đáp án
Đáp án C
Trong một nhóm A, theo chiều từ trên xuống dưới bán kính nguyên tử tăng dần.
Câu 18:
21/07/2024Phát biểu nào sau đây là sai?
 Xem đáp án
Xem đáp án
Đáp án C
Trong một chu kỳ bán kính nguyên tử kim loại lớn hơn bán kính nguyên tử phi kim.
Câu 19:
23/07/2024X và Y là hai nguyên tố thuộc cùng một chu kỳ, hai nhóm A liên tiếp. Số proton của nguyên tử Y nhiều hơn số proton của nguyên tử X. Tổng số hạt proton trong nguyên tử X và Y là 31. Nhận xét nào sau đây về X, Y là không đúng?
 Xem đáp án
Xem đáp án
Đáp án D
- X và Y là hai nguyên tố thuộc cùng một chu kỳ, hai nhóm A liên tiếp. Số proton của nguyên tử Y nhiều hơn số proton của nguyên tử X => = 1
- Tổng số hạt proton trong nguyên tử X và Y là 31 => = 31
=> = 15 và = 16
Cấu hình e của X:
Cấu hình e của Y:
Xét các phương án:
A đúng vì X có 5e lớp ngoài cùng và Y có 6e lớp ngoài cùng
B đúng vì trong một chu kì theo chiều tăng điện tích hạt nhân độ âm điện tăng dần
C đúng
D sai vì X có 5e lớp ngoài cùng => nhóm VA => oxit cao nhất của X là .
Câu 20:
18/07/2024Số thứ tự ô nguyên tố không cho biết
 Xem đáp án
Xem đáp án
Đáp án C
Số thứ tự ô = số hiệu nguyên tử = số proton trong hạt nhân = số electron trong lớp vỏ.
Câu 21:
17/07/2024Cặp nguyên tố nào sau đây có tính chất tương tự nhau?
 Xem đáp án
Xem đáp án
Đáp án A
Na và K thuộc cùng nhóm IA nên có tính chất hóa học tương tự nhau.
Câu 22:
23/07/2024Cho các nguyên tử . Thứ tự tăng dần bán kính của các nguyên tử trên là
 Xem đáp án
Xem đáp án
Đáp án C
Có Na và K cùng thuộc nhóm IA, bán kính nguyên tử K > Na.
Có Na và Mg cùng thuộc chu kỳ 3, bán kính nguyên tử Na > Mg.
Câu 23:
21/07/2024Liên kết trong phân tử NaBr là liên kết nào?
 Xem đáp án
Xem đáp án
Đáp án C
Liên kết hình thành giứa Na (kim loại điển hình) và Br (phi kim điển hình) là liên kết ion.
Câu 25:
22/07/2024Ion Y- có 18 electron. Trong bảng tuần hoàn, Y thuộc ô số
 Xem đáp án
Xem đáp án
Đáp án A
Y + 1e → Y-
Số electron của Y là 17, Y thuộc ô 17.
Câu 26:
06/07/2024Hai nguyên tố A và B thuộc cùng một phân nhóm chính ở chu kì 2 và 3 có số đơn vị điện tích hạt nhân hơn kém nhau là
 Xem đáp án
Xem đáp án
Đáp án A
Câu 27:
03/07/2024Số hiệu nguyên tử Z của nguyên tố X, A, M, Q lần lượt là 6, 7, 20, 19. Nhận xét nào sau đây đúng?
 Xem đáp án
Xem đáp án
Đáp án C
X: [He]
A: [He]
M: [Ar]
Q: [Ar]
→ X; A thuộc chu kỳ 2; M; Q thuộc chu kỳ 4.
Câu 28:
03/07/2024Trong tự nhiên oxi có 3 đồng vị bền: còn cacbon có 2 đồng vị bền . Số lượng phân tử tạo thành từ các đồng vị trên là
 Xem đáp án
Xem đáp án
Đáp án B
Với lần lượt có các phân tử là:
; ; ; ; ; .
Tương tự với cũng có 6 phân tử được lập thành.
Câu 29:
19/07/2024Trong tự nhiên Cu có hai đồng vị: . Khối lượng nguyên tử trung bình của Cu là 63,54. Thành phần % về khối lượng của trong CuCl2 là giá trị nào dưới đây? Biết MCl=35,5.
 Xem đáp án
Xem đáp án
Đáp án D
Gọi phần trăm đồng vị = x, thì % đồng vị = 100 - x
Ta có
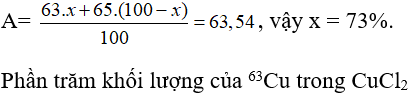
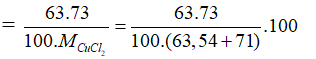
=34,18%
Bài thi liên quan
-
Đề thi Hóa học 10 Giữa học kì 1 năm 2020 - 2021 có đáp án (Đề 1)
-
30 câu hỏi
-
45 phút
-
-
Đề thi Hóa học 10 Giữa học kì 1 năm 2020 - 2021 có đáp án (Đề 3)
-
30 câu hỏi
-
45 phút
-
-
Đề thi Hóa học 10 Giữa học kì 1 năm 2020 - 2021 có đáp án (Đề 4)
-
30 câu hỏi
-
45 phút
-
Có thể bạn quan tâm
- Đề thi giữa kì 1 Hóa 10 cực hay có đáp án (Bài kiểm tra số 2) (306 lượt thi)
- Đề thi Học kì 1 Hóa 10 có đáp án (328 lượt thi)
- Đề kiểm tra 15 phút Hóa học 10 Học kì 1 có đáp án (Bài số 1) (2600 lượt thi)
- Đề thi giữa kì 1 Hóa học 10 có đáp án (Bài số 1) (757 lượt thi)
- Đề kiểm tra 15 phút Hóa 10 Học kì 1 có đáp án (Bài số 2 - Đề 1) (618 lượt thi)
- Đề thi giữa kì 1 Hóa học 10 có đáp án (Bài số 2) (733 lượt thi)
- Đề thi Hóa 10 Học kì 1 (555 lượt thi)
- Đề thi Hóa học 10 Giữa học kì 1 biên soạn (446 lượt thi)
- Đề thi Hóa học 10 Giữa học kì 1 năm 2020 - 2021 có đáp án (501 lượt thi)
Các bài thi hot trong chương
- Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (3252 lượt thi)
- Đề kiểm tra 15p Hóa 10 Học kì 2 (Bài số 2) (1270 lượt thi)
- Đề thi giữa kì 2 Hóa 10 (Bài số 1) (865 lượt thi)
- Đề thi Học kì 2 Hóa 10 cực hay có đáp án (828 lượt thi)
- Đề thi giữa kì 2 Hóa 10 (Bài số 2) (685 lượt thi)
- Đề kiểm tra 15 phút - Trắc nghiệm + Tự luận (674 lượt thi)
- Đề thi Hóa 10 Học kì 2 (Bài kiểm tra học kì) (655 lượt thi)
- Đề kiểm tra 15p Hóa 10 Học kì 2 (Bài số 1) (609 lượt thi)
- Đề thi giữa kì 2 Hóa 10 cực hay có đáp án (395 lượt thi)