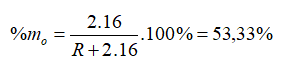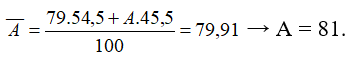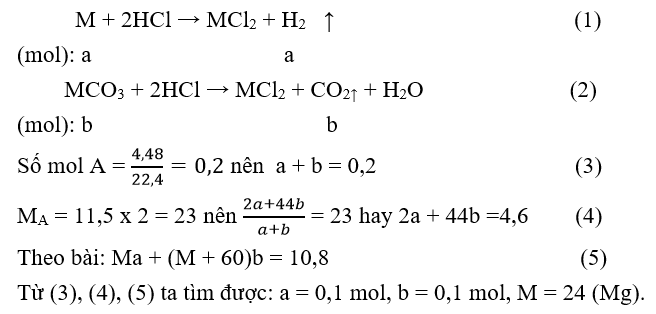Đề thi giữa kì 1 Hóa học 10 có đáp án (Bài số 2)
Đề thi giữa kì 1 Hóa 10 có đáp án (Bài số 2 - Đề 1)
-
734 lượt thi
-
30 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
03/07/2024Nguyên tử X và Y có hiệu số nguyên tử lần lượt là 19 và 15. Nhận xét nào sau đây đúng?
 Xem đáp án
Xem đáp án
Chọn C
Cấu hình electron nguyên tử X là: → X có 1electron lớp ngoài cùng, vậy X là kim loại.
Cấu hình electron nguyên tử của Y là: → Y có 5electron lớp ngoài cùng, vậy Y là phi kim.
Câu 3:
03/07/2024Liên kết trong phân tử là
 Xem đáp án
Xem đáp án
Chọn D
Liên kết hình thành giữa 2 nguyên tử phi kim giống nhau là liên kết cộng hóa trị không phân cực.
Câu 4:
20/07/2024Cho cấu hình electron của các nguyên tử sau:
(X)
(Y)
(Z)
(T)
Dãy các cấu hình electron của các nguyên tử kim loại là
 Xem đáp án
Xem đáp án
Chọn B
X có 5 electron lớp ngoài cùng nên là phi kim → loại các đáp án A, C và D.
Câu 5:
20/07/2024Trong một chu kì, theo chiều tăng của điện tích hạt nhân nguyên tử, số oxi hóa cao nhất của các nguyên tố nhóm A trong oxit biến đổi như thế nào?
 Xem đáp án
Xem đáp án
Chọn D
Trong 1 chu kì, theo chiều tăng dần của điện tích hạt nhân nguyên tử, số oxi hóa cao nhất của các nguyên tố nhóm A trong oxit tăng dần.
Câu 6:
10/07/2024Liên kết trong phân tử KCl là liên kết nào?
 Xem đáp án
Xem đáp án
Chọn C
Liên kết hình thành giữa kim loại điển hình và phi kim điển hình là liên kết ion.
Câu 7:
16/07/2024Nguyên tố R có Z = 35, vị trí của R trong bảng tuần hoàn là
 Xem đáp án
Xem đáp án
Chọn A
Cấu hình electtron của R là
R có 4 lớp electron vậy R ở chu kỳ 4.
R có 7 electron lớp ngoài cùng, nguyên tố p, vậy R thuộc nhóm VIIA.
Câu 8:
07/07/2024Chu kỳ là tập hợp các nguyên tố, mà nguyên tử của chúng có cùng?
 Xem đáp án
Xem đáp án
Chọn C
Các nguyên tố có cùng số lớp electron được xếp thành 1 chu kỳ.
Câu 9:
03/07/2024Trong bảng tuần hoàn các nguyên tố, số chu kỳ nhỏ và chu kì lớn là
 Xem đáp án
Xem đáp án
Chọn C
Bảng tuần hoàn các nguyên tố hóa học gồm 3 chu kì nhỏ và 4 chu kì lớn
Câu 10:
21/07/2024Nguyên tố X thuộc chu kỳ 3, nhóm IIA trong bảng tuần hoàn. Ở trạng thái cơ bản, số lớp electron của X là?
 Xem đáp án
Xem đáp án
Chọn B
Số lớp electron của X bằng số thứ tự chu kỳ và bằng 3.
Câu 11:
20/07/2024Hợp chất khí với Hiđro của một nguyên tố là RH4. Oxit cao nhất của nó có chứa 53,33% oxi về khối lượng. Nguyên tố đó là
 Xem đáp án
Xem đáp án
Chọn B
Hợp chất khí với Hiđro của một nguyên tố là => R có hóa trị IV trong hợp chất khí với H. Hóa trị của R trong hợp chất oxit cao nhất là VIII - IV = IV => Oxit cao nhất là
→ R = 28
Vậy R là Si (Silic).
Câu 13:
23/07/2024Độ âm điện là
 Xem đáp án
Xem đáp án
Chọn D
Độ âm điện là đại lượng đặc trương cho khả năng hút electron của nguyên tử nguyên tử nguyên tố đó khi hình thành liên kết hóa học.
Câu 14:
14/07/2024Cấu hình electron của nguyên tử nguyên tố X là Số hiệu nguyên tử của X là?
 Xem đáp án
Xem đáp án
Chọn C
Số electron của X là 16 → Số hiệu nguyên tử X là 16.
Câu 15:
15/07/2024Nguyên tử khối trung bình của nguyên tố R là 79,91. R có 2 đồng vị. Biết chiếm 54,5%. Nguyên tử khối của đồng vị còn lại có giá trị là
 Xem đáp án
Xem đáp án
Chọn C
- Phần trăm của đồng vị còn lại là 100% - 54,5% = 45,5%
- Công thức tính nguyên tử khối trung bình:
Câu 16:
11/07/2024Nguyên tố hóa học là gì?
 Xem đáp án
Xem đáp án
Chọn B
Nguyên tố hóa học là những nguyên tử có cùng điện tích hạt nhân
Câu 17:
21/07/2024Nguyên tử của nguyên tố X có tổng số hạt là 40. Tổng số hạt mang điện nhiều hơn tổng số hạt không mang điện là 12 hạt. Nguyên tố X có số khối là
 Xem đáp án
Xem đáp án
Chọn A
Gọi số proton, nơtron và electron trong X lần lượt là p, n và e.
Trong đó số p = số e.
-Tổng số hạt trong X bằng 40 nên 2p + n = 40 (1)
-Số hạt mang điện (p,e) nhiều hơn số hạt không mang điện (n) là 12 nên 2p –n =12 (2)
- Giải (1) và (2) thu được p =13 và n =14
Số khối A=13+14=27.
Câu 19:
21/07/2024Cation R+ có cấu hình e phân lớp ngoài cùng là . Liên kết giữa nguyên tử nguyên tố R với oxi thuộc loại liên kết gì?
 Xem đáp án
Xem đáp án
Chọn B
Cấu hình electron của R là → R là kim loại điển hình nhóm IA.
Liên kết hình thành giữa R (kim loại điển hình) và Oxi (phi kim điển hình) là liên kết ion.
Câu 20:
19/07/2024Nguyên tử các nguyên tố halogen được sắp xếp theo chiều bán kính nguyên tử giảm dần (từ trái sang phải) là
 Xem đáp án
Xem đáp án
Chọn D
Chiều giảm dần bán kính nguyên tử: I, Br, Cl, F.
Câu 21:
03/07/2024Phát biểu nào sau đây là không đúng?
 Xem đáp án
Xem đáp án
Chọn C
Oxit cao nhất của một nguyên tố ở nhóm VIIA luôn có công thức
Câu 25:
20/07/2024M là kim loại thuộc nhóm IIA. Hòa tan hết 10,8 gam hỗn hợp kim loại và muối cacbonat của nó trong dung dịch HCl, thu được 4,48 lít hỗn hợp khí A (đktc). Tỷ khối của A so với khí hiđro là 11,5. Kim loại M là
 Xem đáp án
Xem đáp án
Chọn B
Gọi số mol các chất trong hỗn hợp đầu: M = a mol;
Câu 27:
03/07/2024Cấu hình electron ở trạng thái cơ bản của nguyên tử nguyên tố X có tổng số electron trong các phân lớp p là 8. Nguyên tố X là
 Xem đáp án
Xem đáp án
Chọn D
Cấu hình electron ở trạng thái cơ bản của nguyên tử nguyên tố X có tổng số electron trong các phân lớp p là 8
→ X có 6 electron ở phân lớp 2p và 2 electron ở phân lớp 3p
Bài thi liên quan
-
Đề thi giữa kì 1 Hóa 10 có đáp án (Bài số 2 - Đề 2)
-
30 câu hỏi
-
45 phút
-
-
Đề thi giữa kì 1 Hóa 10 có đáp án (Bài số 2 - Đề 3)
-
30 câu hỏi
-
45 phút
-
-
Đề thi giữa kì 1 Hóa 10 có đáp án (Bài số 2 - Đề 4)
-
30 câu hỏi
-
45 phút
-
Có thể bạn quan tâm
- Đề thi giữa kì 1 Hóa 10 cực hay có đáp án (Bài kiểm tra số 2) (306 lượt thi)
- Đề thi Học kì 1 Hóa 10 có đáp án (328 lượt thi)
- Đề kiểm tra 15 phút Hóa học 10 Học kì 1 có đáp án (Bài số 1) (2600 lượt thi)
- Đề thi giữa kì 1 Hóa học 10 có đáp án (Bài số 1) (757 lượt thi)
- Đề kiểm tra 15 phút Hóa 10 Học kì 1 có đáp án (Bài số 2 - Đề 1) (618 lượt thi)
- Đề thi giữa kì 1 Hóa học 10 có đáp án (Bài số 2) (733 lượt thi)
- Đề thi Hóa 10 Học kì 1 (555 lượt thi)
- Đề thi Hóa học 10 Giữa học kì 1 biên soạn (446 lượt thi)
- Đề thi Hóa học 10 Giữa học kì 1 năm 2020 - 2021 có đáp án (502 lượt thi)
Các bài thi hot trong chương
- Đề thi Học kì 2 Hóa học 10 cực hay có đáp án (3252 lượt thi)
- Đề kiểm tra 15p Hóa 10 Học kì 2 (Bài số 2) (1270 lượt thi)
- Đề thi giữa kì 2 Hóa 10 (Bài số 1) (865 lượt thi)
- Đề thi Học kì 2 Hóa 10 cực hay có đáp án (828 lượt thi)
- Đề thi giữa kì 2 Hóa 10 (Bài số 2) (685 lượt thi)
- Đề kiểm tra 15 phút - Trắc nghiệm + Tự luận (674 lượt thi)
- Đề thi Hóa 10 Học kì 2 (Bài kiểm tra học kì) (655 lượt thi)
- Đề kiểm tra 15p Hóa 10 Học kì 2 (Bài số 1) (609 lượt thi)
- Đề thi giữa kì 2 Hóa 10 cực hay có đáp án (395 lượt thi)