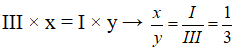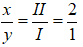Đề kiểm tra 1 tiết Hóa học 8 Chương 1: Chất - Nguyên tử - Phân tử
Đề kiểm tra 1 tiết Hóa học 8 Chương 1: Chất - Nguyên tử - Phân tử (Đề 2)
-
344 lượt thi
-
6 câu hỏi
-
45 phút
Danh sách câu hỏi
Câu 1:
17/07/2024Tổng số hạt trong nguyên tử của một nguyên tố hóa học là 40; trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 12. Xác định số nơtron trong nguyên tử trên
 Xem đáp án
Xem đáp án
Gọi p, n, e lần lượt là số proton, nơtron và electron.
Theo đề bài, ta có: p + n + e = 40 (1)
Vì p = e nên (1) → 2p + n = 40 (*)
Mà: 2p – n = 12 (**)
Từ (*) và (**) → n = 14
Câu 2:
18/07/2024Tính hóa trị của nguyên tố Mn, S, Fe, Cu, N trong mỗi công thức hóa học sau: CuCl, Fe2(SO
 Xem đáp án
Xem đáp án
- Xác định hóa trị của Cu trong CuCl:
Biết Cl có hóa trị I. Gọi hóa trị của Cu là a, ta có: 1 × a = 1 × I, rút ra a = I.
- Hóa trị của Mn, S, Fe, Cu, N trong các hợp chất còn lại là:
(N hóa ttrị IV);
(Fe hóa trị II);
(N hóa trị III);
(Mn hóa trị II);
(S hóa trị VI);
(S hóa trị II).
Câu 3:
17/07/2024Nêu ý nghĩa của các công thức hóa học sau:
 Xem đáp án
Xem đáp án
- Công thức
Hợp chất trên gồm 3 nguyên tố: Fe, S và O tạo nên.
Có 2 nguyên tử Fe, 3 nguyên tử S và 12 nguyên tử O trong phân tử.
Phân tử khối bằng: 56.2 + 3.32 + 16.12 = 400 (đvC).
- Công thức cho biết:
Khí ozon do nguyên tố oxi tạo nên
Có 3 nguyên tử oxi trong một phân tử
Phân tử khối bằng: 16.3 = 48 (đvC)
- Công thức cho biết:
Hợp chất này gồm 3 nguyên tố Cu, S và O tạo nên.
Có 1 nguyên tử Cu, 1 nguyên tử S và 4 nguyên tử O trong phân tử.
Phân tử khối bằng: 64 + 32 + 16 × 4 = 160 (đvC).
Câu 4:
17/07/2024Lập công thức hóa học, tính phân tử khối của những hợp chất tạo bởi (công thức đầu ghi đủ các bước, các công thức sau chỉ ghi kết quả): Nguyên tố sắt(III) với nguyên tố Cl (I); nhóm (II); nhóm (I); nhóm (III); nhóm OH (I).
 Xem đáp án
Xem đáp án
– Fe(III) với Cl(I).
Công thức chung có dạng:
Theo quy tắc hóa trị, ta có:
Công thức hóa học là:
Phân tử khối là: 56 + 35,5 × 3 = 162,5 đvC.
– Các hợp chất của Nguyên tố sắt (III) với nhóm (II); nhóm (I); nhóm (III); nhóm OH (I) lần lượt là:
Phân tử khối của là 56 × 2 + (32 + 16 × 4) × 3 = 400 đvC.
Phân tử khối của là 56 + (14 + 16 × 3) × 3 = 242 đvC.
Phân tử khối của là 56 + 31 + 16 × 4 = 151 đvC.
Phân tử khối của là 56 + (1 + 16) × 3 = 107 đvC.
Câu 5:
17/07/2024Lập công thức hóa học, tính phân tử khối của những hợp chất tạo bởi (công thức đầu ghi đủ các bước, các công thức sau chỉ ghi kết quả): Nguyên tố S (II) với nguyên tố H; nguyên tố S (IV) với nguyên tố O; nguyên tố S (VI) với nguyên tố O.
 Xem đáp án
Xem đáp án
Đáp án
- H với S (II)
Công thức chung có dạng:
Theo quy tắc hóa trị, ta có: I × x = II × y
→
Công thức hóa học là:
Phân tử khối của là 1 × 2 + 32 = 34.
- Hợp chất tạo bởi nguyên tố S (IV) với nguyên tố O là
Phân tử khối của là 32 + 16 × 2 = 64.
- Hợp chất tạo bởi nguyên tố S (VI) với nguyên tố O là .
Phân tử khối của là 32 + 16 × 3 = 80.
Câu 6:
17/07/2024Biết:
- Hợp chất giữa nguyên tố X với nhóm là
- Hợp chất giữa nguyên tố Y với nguyên tố H là
Hãy xác định công thức hóa học giữa X và Y (không tính phân tử khối).
 Xem đáp án
Xem đáp án
Trong
Trong nguyên tử Y có hóa trị III.
Vậy công thức hóa học giữa X và Y là XY.
Bài thi liên quan
-
Đề kiểm tra 1 tiết Hóa học 8 Chương 1: Chất - Nguyên tử - Phân tử (Đề 1)
-
4 câu hỏi
-
45 phút
-
-
Đề kiểm tra 1 tiết Hóa học 8 Chương 1: Chất - Nguyên tử - Phân tử (Đề 3)
-
5 câu hỏi
-
45 phút
-
-
Đề kiểm tra 1 tiết Hóa học 8 Chương 1: Chất - Nguyên tử - Phân tử (Đề 4)
-
5 câu hỏi
-
45 phút
-