Chuyên đề Hóa 10 Bài 3. Năng lượng hoạt hóa của phản ứng hóa học có đáp án
Chuyên đề Hóa 10 Bài 3. Năng lượng hoạt hóa của phản ứng hóa học có đáp án
-
649 lượt thi
-
14 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
23/07/2024Trong ruột non của hầu hết chúng ta đều có enzyme lactase, có tác dụng chuyển hóa lactose (còn gọi là đường sữa, C12H22O11) có trong thành phần của sữa và các sản phẩm từ sữa thành đường glucose (C6H12O6) và galactose (C6H12O6) giúp cơ thể dễ dàng hấp thu; quá trình này đặc biệt quan trọng đối với sự phát triển và tăng cường miễn dịch của trẻ nhỏ. Khi cơ thể thiếu hụt loại enzyme này, lactose không được tiêu hóa sẽ bị vi khuẩn lên men, sinh ra khí và gây đau bụng. Enzyme lactase đóng vai trò xúc tác trong quá trình chuyển hóa lactose. Xúc tác ảnh hưởng như thế nào đến tốc độ chuyển hóa giữa các chất?
 Xem đáp án
Xem đáp án
Chất xúc tác có vai trò làm giảm năng lượng hoạt hóa để tăng tốc độ phản ứng.
Câu 2:
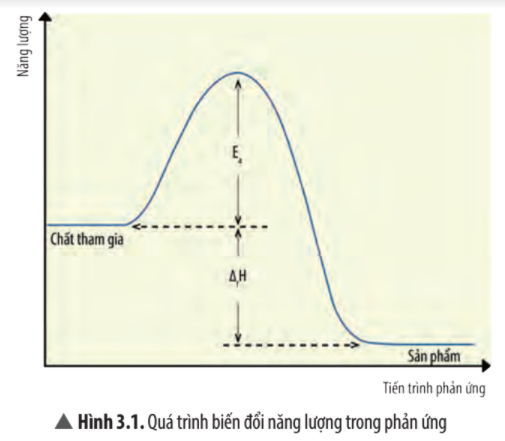
17/07/2024Quan sát Hình 3.1, cho biết số va chạm hiệu quả và khả năng xảy ra phản ứng của chất tham gia thay đổi như thế nào khi giá trị của năng lượng hoạt hóa càng giảm?
 Xem đáp án
Xem đáp án
Năng lượng hoạt hóa càng giảm thì số va chạm hiệu quả càng giảm và khả năng xảy ra phản ứng của chất tham gia càng giảm.
Khi năng lượng hoạt hóa giảm đến dưới mức năng lượng tối thiểu thì các chất tham gia phản ứng không tạo ra được các va chạm hiệu quả dẫn đến không hình thành được sản phẩm.
Câu 3:
14/07/2024Từ thông tin trong phần Khởi động, khi có chất xúc tác, năng lượng hoạt hóa của phản ứng chuyển hóa lactose tăng hay giảm? Giải thích.
 Xem đáp án
Xem đáp án
Câu 4:
13/07/2024Khả năng xảy ra của một phản ứng hóa học như thế nào khi năng lượng hoạt hóa của phản ứng rất lớn? Giải thích.
 Xem đáp án
Xem đáp án
Câu 5:
23/07/2024Dựa vào phương trình Arrhenius, tốc độ phản ứng thay đổi như thế nào khi tăng nhiệt độ của phản ứng?
 Xem đáp án
Xem đáp án
Dựa vào phương trình Arrhenius, tốc độ phản ứng tại thời điểm T1 là:
(1)
Tốc độ phản ứng tại thời điểm T2 là:
(2)
Chia hai vế phương trình (2) cho (1), thu được:
Khi tăng nhiệt độ tức là T2 > T1
⇒ > 1 ⇒ Tốc độ phản ứng tăng.
Câu 6:
13/07/2024Từ Ví dụ 2, tốc độ phản ứng phân hủy N2O5 thay đổi như thế nào khi giảm nhiệt độ về 25oC? Nhận xét ảnh hưởng của nhiệt độ đến tốc độ phản ứng.
 Xem đáp án
Xem đáp án
Dựa vào phương trình Arrhenius ta có:
⇔
⇔ hay
Vậy, khi giảm nhiêt độ về 25oC thì tốc độ phản ứng giảm 13,84 lần.Câu 7:
23/07/2024Một phản ứng có năng lượng hoạt hóa là 24 kJ/mol, so sánh tốc độ phản ứng ở 2 nhiệt độ là 27oC và 127oC.
 Xem đáp án
Xem đáp án
Dựa vào phương trình Arrhenius, tốc độ phản ứng tại thời điểm T1 là:
(1)
Tốc độ phản ứng tại thời điểm T2 là:
(2)
Chia hai vế phương trình (2) cho (1), thu được:
Hay
Thay số vào ta được:
⇔ = 11,08
Vậy khi tăng nhiệt độ từ 27oC lên 127oC thì tốc độ phản ứng tăng 11,08 lần.
Câu 8:
22/07/2024Nhận xét ảnh hưởng của enzyme đối với năng lượng hoạt hóa của phản ứng.
 Xem đáp án
Xem đáp án
Enzyme là chất xúc tác sinh học, có vai trò làm tăng tốc độ phản ứng.
Mà theo phương trình Arrhenius, tốc độ phản ứng tăng thì năng lượng hoạt hóa của phản ứng giảm.
Vậy enzyme có vai trò làm giảm năng lượng hoạt hóa của phản ứng.
Câu 9:
17/07/2024Trong công nghiệp hóa chất, người ta sử dụng chất xúc tác để tăng tốc độ của phản ứng, như phản ứng tổng hợp SO3 từ SO2 và O2 dùng xúc tác V2O5. Hãy kể tên một số xúc tác cho các phản ứng mà em biết.
 Xem đáp án
Xem đáp án
+ H2 phản ứng vô cùng chậm với O2 ở nhiệt độ phòng, nhưng khi thổi khí H2 qua lưới kim loại platinum (Pt) trong không khí, H2 có thể bốc cháy. Trong trường hợp này, Pt đóng vai trò làm chất xúc tác cho phản ứng:
2H2 + O2 2H2O
+ Trong các nhà máy sản xuất phân đạm người ta thường dùng sắt làm chất xúc tác để tăng tốc độ phản ứng giữa nitrogen (N2) và hydrogen (H2)
N2 + 3H2 2NH3
+ Hỗn hợp bột aluminium và iodine ở nhiệt độ thường không có phản ứng xảy ra, nhưng khi cho thêm một ít nước làm xúc tác, phản ứng xảy ra mãnh liệt, tạo hợp chất aluminium iodine.
2Al + 3I2 2AlI3
Câu 10:
14/07/2024Tại sao muốn cá, thịt mau mềm, người ta thường chế biến kèm với những lát dứa (thơm) hoặc thêm một ít nước ép của dứa?
 Xem đáp án
Xem đáp án
Trong dứa có một loại enzyme tên là enzyme bromelain, enzyme này có tác dụng phân giải protein thành các chuỗi peptit ngắn hơn.
Thịt được cấu tạo chủ yếu bởi protein, khi hầm chung với dứa, enzyme này trong dứa sẽ phân giải protein trong thịt, giúp nhanh mềm và dễ tiêu hóa, hấp thu hơn.
Câu 11:
19/07/2024Cho giản đồ năng lượng của các phản ứng:
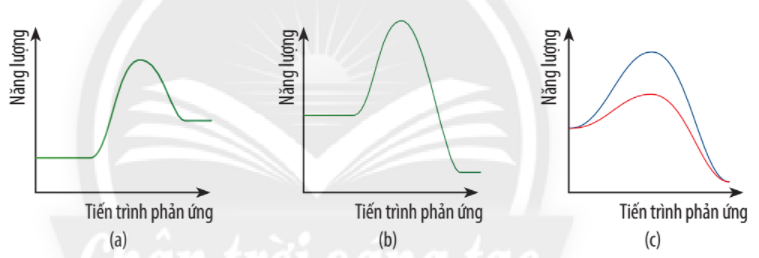
a) Hãy biểu diễn năng lượng hoạt hóa trên giản đồ năng lượng của phản ứng trong từng trường hợp.
b) Giản đồ năng lượng nào biểu diễn ảnh hưởng của xúc tác đến năng lượng hoạt hóa của phản ứng?
 Xem đáp án
Xem đáp án
a) Trong giản đồ (c) Ea’ là năng lượng hoạt hóa của phản ứng khi không có xúc tác.
Ea là năng lượng hoạt hóa của phản ứng khi có xúc tác.
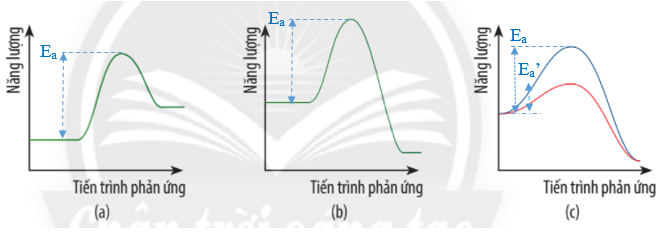
b) Giản đồ (c) biểu diễn ảnh hưởng của xúc tác đến năng lượng hoạt hóa của phản ứng.
Đường màu xanh là năng lượng hoạt hóa khi không có xúc tác.
Đường màu đỏ là năng lượng hoạt hóa khi có xúc tác.
Câu 12:
22/07/2024Cho hằng số tốc độ của một phản ứng là 11M-1.s-1 tại nhiệt độ 345 K và hằng số thực nghiệm Arrhenius là 20 M-1.s-1 . Tính năng lượng hoạt hóa của phản ứng trên.
 Xem đáp án
Xem đáp án
Áp dụng phương trình Arrhenius:
⇔ ⇒ Ea = 1715 kJ/mol
Câu 13:
22/07/2024Tìm hằng số tốc độ phản ứng k ở 273 K của phản ứng phân hủy
N2O5(g) → N2O4(g) + O2(g)
Biết rằng ở 300K, năng lượng hoạt hóa là 111 kJ/mol và hằng số tốc độ phản ứng là
10-10s-1.
 Xem đáp án
Xem đáp án
Áp dụng phương trình Arrhenius viết lại cho hai nhiệt độ
T1 = 300K; T2 = 273K ứng với hai hằng số tốc độ k1 = 10-10s-1; k2 = ?
⇔
⇔ k2 = 1,23.10-12s-1
Vậy hằng số tốc độ phản ứng ở 273 K của phản ứng phân hủy là k2 = 1,23.10-12 s-1
Câu 14:
20/07/2024Phản ứng tổng hợp SO3 trong dây chuyền sản xuất sulfuric acid:
2SO2(g) + O2(g) → 2SO3(g)
Tốc độ phản ứng thay đổi như thế nào khi tăng nhiệt độ từ 350oC lên 450oC.
Biết năng lượng hoạt hóa của phản ứng là 314 kJ/mol.
 Xem đáp án
Xem đáp án
Áp dụng phương trình Arrhenius theo nhiệt độ:
Thay số vào ta được:
⇔ = 4380,03
Vậy khi tăng nhiệt độ từ 350oC lên 450oC thì tốc độ phản ứng tăng 4380,03 lần.
