Bài tập Thực hành thí nghiệm hóa học ảo có đáp án
Bài tập Thực hành thí nghiệm hóa học ảo có đáp án
-
77 lượt thi
-
9 câu hỏi
-
40 phút
Danh sách câu hỏi
Câu 1:
13/07/2024Làm thế nào thực hiện được các thí nghiệm hoá học ảo trên máy tính?
 Xem đáp án
Xem đáp án
Trả lời:
Để thực hiện các thí nghiệm hóa học ảo trên máy tính cần có phần mềm mô phỏng thí nghiệm ảo như Portable Virtual Chemistry Lab hay ChemLab, Yenka, …
Câu 2:
13/07/2024Sử dụng thẻ Open-local để mô phỏng thí nghiệm đo tốc độ phản ứng:
2HCl(aq) + CaCO3(s) ⟶ CaCl2(aq) + CO2(g) + H2O(l) (1)
 Xem đáp án
Xem đáp án
Trả lời:
Cách tiến hành
- Bước 1. Nháy chuột vào thẻ Open-local, chọn Reaction Rates.
- Bước 2. Nháy chuột vào Definition of reaction rate (Định nghĩa tốc độ phản ứng). Một mô phỏng đã được thiết kế xuất hiện ở màn hình bên phải.

- Bước 3. Nháy chuột trái vào dòng chữ chỉ hóa chất Calcium carbonate rồi kéo thả vào ống nghiệm (Test tube), sau đó kéo thả hoá chất Hydrochloric acid vào ống nghiệm.
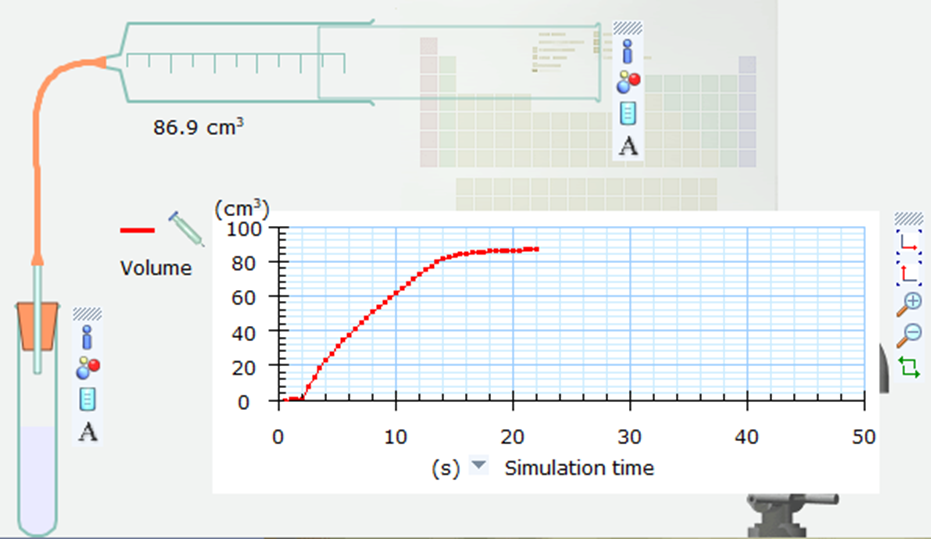
- Bước 4. Nháy chuột vào nút Pause ở góc dưới bên phải của màn hình mô phỏng để thực hiện mô phỏng. Sau khoảng 20 giây trên trục thời gian mô phỏng, nháy chuột lại vào nút Pause để dừng mô phỏng. Khi đó trên bảng giấy kẻ ô ở màn hình mô phỏng xuất hiện đường cong màu đỏ biểu diễn thể tích khí CO2 thu được theo thời gian.
Câu 3:
16/07/2024Hãy tính tốc độ trung bình của phản ứng (1) trong khoảng thời gian từ 0 đến 20 giây theo thể tích CO2.
 Xem đáp án
Xem đáp án
Trả lời:
Từ đồ thị ta thấy, sau 20s thì thể tích khí thoát ra là 88 cm3.
⇒ Tốc độ trung bình của phản 1) trong khoảng thời gian từ 0 đến 20 giây theo thể tích CO2 là: cm3/s
Câu 4:
13/07/2024Sử dụng thẻ Open-local để mô phỏng thí nghiệm về ảnh hưởng của nồng độ acid HCl đến tốc độ phản ứng
2HCl(aq) + CaCO3(s) ⟶ CaCl2(aq) + CO2(g) + H2O(l)
 Xem đáp án
Xem đáp án
Trả lời:
Cách tiến hành:
Bước 1. Nháy chuột vào thẻ Open-local, chọn Reaction Rates.
Bước 2. Nháy chuột vào Concentration and rate (ảnh hưởng của nồng độ lên tốc độ phản ứng). Một mô phỏng đã được thiết kế xuất hiện ở màn hình bên phải.
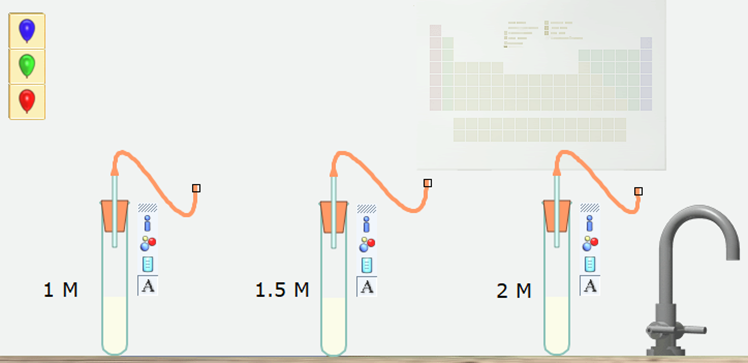
Bước 3. Nháy chuột vào các quả bóng có màu khác nhau, kéo thả vào cuối ống dẫn khí ở các ống nghiệm có nồng độ khác nhau.
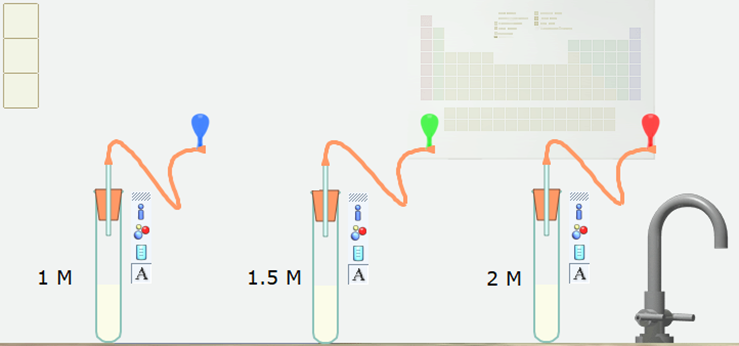
Bước 4. Nháy chuột vào nút Pause để thực hiện mô phỏng. Sau khoảng 9 giây nháy chuột lại vào nút Pause để dừng mô phỏng.
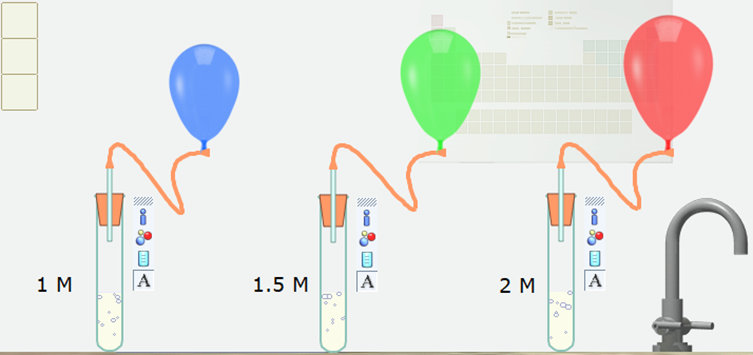
Câu 5:
13/07/2024Khi khí thoát ra, các quả bóng to dần lên. Hãy quan sát tốc độ tăng dần kích thước của các quả bóng và cho biết tốc độ thoát khí CO2 ở ống nghiệm nào nhanh nhất, ở ống nghiệm nào chậm nhất? Nồng độ ảnh hưởng như thế nào đến tốc độ phản ứng?
 Xem đáp án
Xem đáp án
Trả lời:
Tốc độ thoát khí CO2 ở ống nghiệm có nồng độ chất tan 2M là nhanh nhất.
Tốc độ thoát khí CO2 ở ống nghiệm có nồng độ chất tan 1M là chậm nhất.
⇒ Nồng độ của các chất tham gia tăng thì tốc độ phản ứng tăng.
Câu 6:
13/07/2024Sử dụng thẻ Open-local để mô phỏng các thí nghiệm sau:
- Thí nghiệm ảnh hưởng của nhiệt độ đến tốc độ của phản ứng (giữa CaCO3(s) và HCl(aq)).
- Thí nghiệm ảnh hưởng của chất xúc tác MnO2 đến tốc độ phản ứng phân hủy H2O2(aq).
 Xem đáp án
Xem đáp án
Trả lời:
- Thí nghiệm ảnh hưởng của nhiệt độ đến tốc độ của phản ứng (giữa CaCO3(s) và HCl(aq)).
Bước 1: Khởi động phần mềm Yenka.
Bước 2: Chọn Open -local ⟶ Temperature and rate
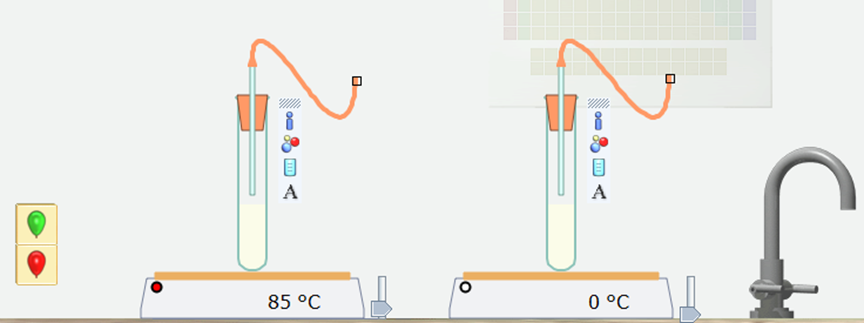
Bước 3: Nháy chuột vào các quả bóng có màu khác nhau, kéo thả vào cuối ống dẫn khí ở các ống nghiệm có nồng độ khác nhau.
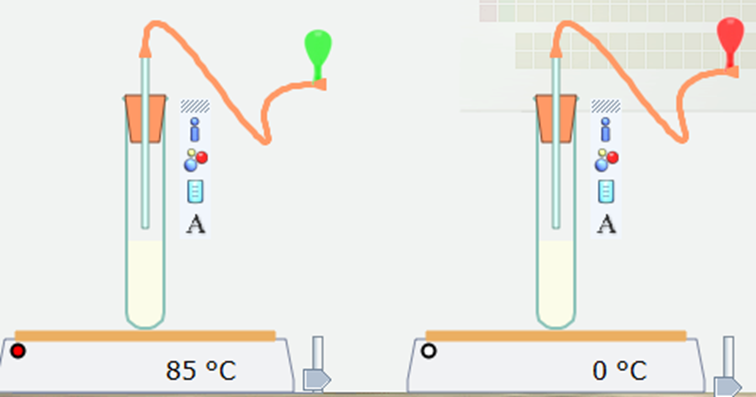
Bước 4. Nháy chuột vào nút Pause để thực hiện mô phỏng. Sau khoảng 6 giây nháy chuột lại vào nút Pause để dừng mô phỏng.
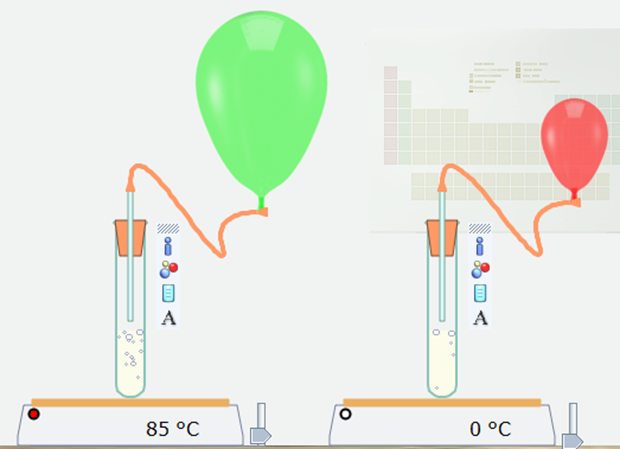
- Thí nghiệm ảnh hưởng của chất xúc tác MnO2 đến tốc độ phản ứng phân hủy H2O2(aq).
Bước 1: Khởi động phần mềm Yenka.
Bước 2: Chọn Open -local ⟶ Catalysts and rate.
Bước 3: Nháy chuột trái vào dòng chữ chỉ hóa chất Hydrogen peroxide rồi kéo thả lần lượt vào 2 ống nghiệm (Test tube), sau đó kéo thả hoá chất Manganeses(IV) oxide vào 1 trong 2 ống nghiệm.
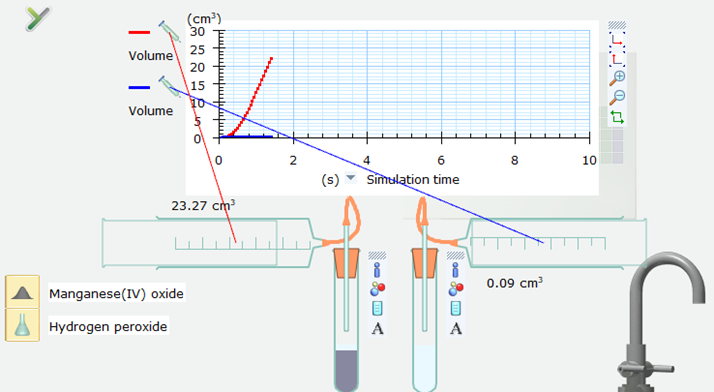
Bước 4. Nháy chuột vào nút Pause ở góc dưới bên phải của màn hình mô phỏng để thực hiện mô phỏng. Sau khoảng 1 giây trên trục thời gian mô phỏng, nháy chuột lại vào nút Pause để dừng mô phỏng.
Câu 7:
15/07/2024Sử dụng thẻ New để mô phỏng thí nghiệm copper tác dụng với dung dịch nitric acid.
 Xem đáp án
Xem đáp án
Trả lời:
Cách tiến hành
Bước 1. Nháy chuột vào thẻ New, chọn hoá chất (Chemicals).
Nháy chuột vào Chemicals ⟶ Metals ⟶ Lumps ⟶ Copper, kéo thả sang màn hình mô phỏng. Để chọn nitric acid, nháy chuột vào Chemical ⟶ Acids. Nháy chuột vào Nitric acid, kéo thả sang màn hình mô phỏng.
Bước 2. Chọn thiết bị, dụng cụ.
Nháy chuột vào công cụ Glassware ⟶ Standard, sau đó nháy chuột vào Beeaker 100 mL (cốc thuỷ tinh 100 mL), kéo và thả sang màn hình mô phỏng.
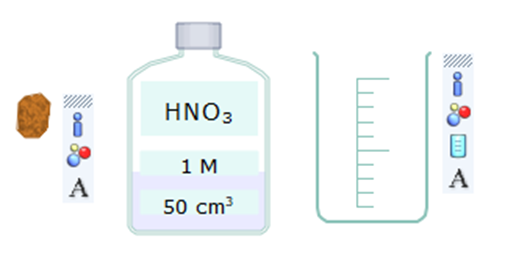
Chọn hóa chất, thiết bị, dụng cụ
Bước 3. Mô phỏng phản ứng.
Nháy chuột vào copper, kéo thả vào cốc thuỷ tinh; nháy chuột vào bình nitric acid, kéo thả vào cốc thuỷ tinh.
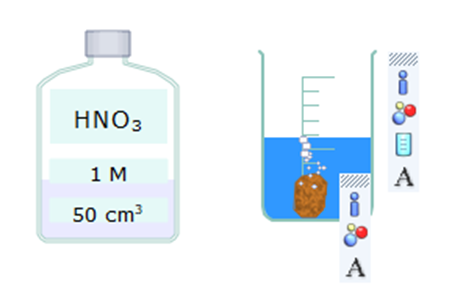
Câu 8:
13/07/2024Nêu hiện tượng và viết phương trình hóa học của phản ứng giữa copper và nitric acid.
 Xem đáp án
Xem đáp án
Trả lời:
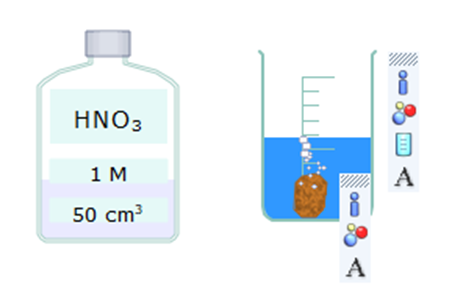
Mô phỏng phản ứng
Hiện tượng: Kim loại đồng (copper) tan dần, có khí thoát ra và dung dịch có màu xanh.
Phương trình hóa học: 8HNO3 + 3Cu ⟶ 3Cu(NO3)2 + 2NO + 4H2O
Câu 9:
13/07/2024Sử dụng phần mềm để mô phỏng một số thí nghiệm hoá học ảo. So sánh ưu điểm và nhược điểm của việc tiến hành thí nghiệm hóa học trên máy tính và trong thực tế.
 Xem đáp án
Xem đáp án
Trả lời:
- Để thiết kế một mô phỏng thí nghiệm hoá học với phần mềm Yenka, các hoá chất (Chemicals) và thiết bị, dụng cụ thí nghiệm (Equipments) sẽ được lấy trong thẻ New.
- So sánh
+ Khái niệm
∎ Thí nghiệm thật: là các thí nghiệm được thực hiện bằng các dụng cụ thí nghiệm thật, các hoá chất thật.
∎ Thí nghiệm ảo: là các thí nghiệm được thực hiện trên máy vi tính, thí nghiệm ảo thực chất là mô hình của thí nghiệm thật trên máy vi tính.
+ So sánh thí nghiệm ảo và thí nghiệm thật
Ưu điểm chung: cả hai đều là thí nghiệm trực quan, cùng làm sáng tỏ lý thuyết, gây hứng thú học tập cho các em, giáo dục tính tò mò khoa học, làm cho học sinh nhận thức dễ dàng hơn, kiến thức thu được của các em rõ ràng và sâu sắc, đồng thời lớp học sôi nổi, hào hứng, …
Tuy nhiên, thí nghiệm có những ưu điểm khác nữa như: dễ dàng quan sát thí nghiệm trên màn hình chiếu; không cần chuẩn bị dụng cụ, hóa chất; thí nghiệm ảo thì luôn thành công; an toàn.
Nhược điểm:
Thí nghiệm hóa học thật
- Hầu như các dụng cụ thí nghiệm đều nhỏ, lớp học đông, phòng học rộng.
⇒ Khi làm thí nghiệm thì không phải tất cả các học sinh trong lớp đều có thể quan sát dễ dàng được, các em ở cuối lớp chỉ có thể nghe giáo viên nói mà không thể nhìn được thí nghiệm giáo viên làm như thế nào và chỉ có một số học sinh ở bàn trên mới có thể quan sát rõ thí nghiệm.
- Không phải thí nghiệm hóa học thật nào cũng tiến hành thành công.
- Mất thời gian và công sức để chuẩn bị dụng cụ, hóa chất thí nghiệm, đôi khi rất cồng kềnh.
- Đôi khi trong quá trình thí nghiệm sẽ xảy ra vấn đề ngoài ý muốn như cháy nổ, …
Thí nghiệm ảo
- Giáo viên và học sinh không cần tiến hành thí nghiệm nên dẫn đến kĩ năng thao tác thí nghiệm kém.
- Giáo viên phải sử dụng thành thạo phần mềm mô phỏng thí nghiệm ảo.
