Bài tập Năng lượng hoạt hóa của phản ứng hóa học có đáp án
Bài tập Năng lượng hoạt hóa của phản ứng hóa học có đáp án
-
156 lượt thi
-
7 câu hỏi
-
40 phút
Danh sách câu hỏi
Câu 1:
15/07/2024Hydrogen và oxygen không phản ứng với nhau ở nhiệt độ thường, nhưng khi đưa một ít bột platinium (Pt) vào hỗn hợp hai khí đó, phản ứng xảy ra ngay tức khắc, tạo thành nước. Yếu tố nào quyết định sự thay đổi đó?
 Xem đáp án
Xem đáp án
Trả lời:
Yếu tố quyết định sự thay đổi trên là chất xúc tác. Chất xúc tác có tác dụng làm tăng tốc độ phản ứng nhưng không bị biến đổi về chất và lượng sau phản ứng.
Câu 2:
13/07/2024Cho phản ứng:
2NOCl(g) ⟶ 2NO(g) + Cl2(g), năng lượng hoạt hóa của phản ứng là 100kJ/mol. Ở 350K, hằng số tốc độ của phản ứng là 8.10-6 L/(mol.s). Tính hằng số tốc độ ở phản ứng ở 400 K.
 Xem đáp án
Xem đáp án
Trả lời:
Ta có:
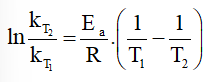
⇒
⇒ L/(mol.s)
Câu 3:
13/07/2024Tính năng lượng hoạt hóa của một số phản ứng biết rằng khi nhiệt độ tăng từ 300 K lên 310 K thì tốc độ phản ứng tăng 3 lần.
 Xem đáp án
Xem đáp án
Trả lời:
Khi nhiệt độ tăng từ 300 K lên 310 K thì tốc độ phản ứng tăng 3 lần.
⇒
Mà ⇒
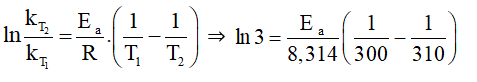
⇒ Ea = 84 944,92 J/mol ≈ 85 kJ/mol
Câu 4:
13/07/2024Thực nghiệm cho biết phản ứng: 2N2O5(g) ⟶ 4NO2(g) + O2(g) ở 45oC có hằng số tốc độ phản ứng là 8,17.10-3 s-1; Ea = 103,5kJ/mol. Tính hằng số tốc độ phản ứng tại 65oC.
 Xem đáp án
Xem đáp án
Trả lời:
Ta có:
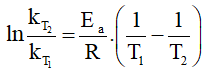
⇒
⇒
Câu 5:
23/07/2024Sự suy giảm tầng ozone và lỗ thủng tầng ozone (O3) đã gây ra mối lo ngại về việc gia tăng nguy cơ ung thư da, chảy năng, mù mắt và đục thuỷ tinh thể.... Tầng ozone ngăn chặn hầu hết các bước sóng có hại của tia cực tím (UV) đi qua bầu khí quyển Trái Đất. Các phân tử ozone có thể bị phá huỷ theo hai giai đoạn
Cl + O3 ⟶ ClO + O2
Và ClO + O3 ⟶ Cl + 2O2
Chất xúc tác trong các quá trình này là chất nào?
 Xem đáp án
Xem đáp án
Trả lời:
Chất xúc tác là Cl vì sau toàn bộ quá trình thì Cl vẫn còn nguyên.
Câu 6:
13/07/2024Một phản ứng xảy ra ở 500°C, năng lượng hoạt hóa của phản ứng khi không có xúc tác và khi có xúc tác lần lượt là 55,4 kJ/mol và 13,5 kJ/mol. Chứng minh rằng chất xúc tác có ảnh hưởng đến tốc độ phản ứng.
 Xem đáp án
Xem đáp án
Trả lời:
Ta thấy: Năng lượng hoạt hóa của phản ứng khi không có xúc tác là 55,4 kJ/mol lớn hơn rất nhiều so với năng lượng hoạt hóa của phản ứng khi có xúc tác là 13,5 kJ/mol.
⇒ Khi có chất xúc tác sẽ làm giảm năng lượng hoạt hóa của phản ứng nên làm tăng tốc độ phản ứng
Câu 7:
13/07/2024Vận dụng khái niệm năng lượng hoạt hoá để giải thích vai trò của xúc tác trong một số quá trình tự nhiên như: tiêu hoá thức ăn trong cơ thể người, động vật, ... và một số quá trình sản xuất: sulfuric acid, acetic acid, rượu, bia, ...
 Xem đáp án
Xem đáp án
Trả lời:
Năng lượng hoạt hóa (Ea) là năng lượng tối thiểu mà các chất phản ứng cần có để phản ứng hóa học có thể xảy ra. Để phản ứng hóa học xảy ra thì các phân tử chất phản ứng phải va chạm vào nhau, nhưng không phải va chạm nào đều gây ra phản ứng, mà chỉ những va chạm có hiệu quả mới gây ra phản ứng. Trên thực tế có rất nhiều phản ứng có năng lượng hoạt hóa lớn như: tiêu hoá thức ăn trong cơ thể người, động vật, ... và một số quá trình sản xuất: sulfuric acid, acetic acid, rượu, bia, ...
⇒ Chất xúc tác làm phản ứng theo nhiều giai đoạn, mỗi giai đoạn có năng lượng hoạt hóa thấp hơn năng lượng của phản ứng khi không có xúc tác, do đó làm tăng tốc độ phản ứng.
Ví dụ:
- Có ba loại enzyme tiêu hóa chính. Chúng được phân loại dựa trên các phản ứng mà chúng giúp xúc tác:
1. Amylase phân hủy tinh bột và carbohydrate thành đường.
2. Protease phân hủy protein thành các axit amin.
3. Lipase phân hủy lipid, là chất béo và dầu, thành glycerol và axit béo.
- Platinium (Pt), vanadium pentoxide (V2O5) được sử dụng trong quá trình oxi hóa SO2 thành SO3 để sản xuất sulfuric acid.
