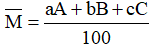50 Bài tập về Đồng vị nâng cao siêu hay có lời giải
Bài tập về Đồng vị nâng cao siêu hay có lời giải (P2)
-
1282 lượt thi
-
15 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
22/10/2024Trong tự nhiên clo có hai đồng vị bền là 35Cl và 37Cl trong đó 35Cl chiếm 75,77% số nguyên tử. Phần trăm khối lượng 37Cl trong HClOn là 13,09%. Giá trị của n là
 Xem đáp án
Xem đáp án
Đáp án đúng: B
*Phương pháp giải:
- 35Cl chiếm 75,77% số nguyên tử ta sẽ tìm ra được % của 35Cl
- từ đó sẽ tính ra được nguyên tử khối trung bình của clo chính là ở trong HClOn luôn
- từ đây áp dụng công thức tính phần trăm khối lượng Cl trong HClOn để tìm ra n
*Lời giải:
• %35Cl = 100% - 75,77% = 24,23%
Nguyên tử khối trung bình của clo là:
Vậy phần trăm khối lượng của 37 trong HClOn là
→ n = 2
* Lý thuyết cần nắm và dạng bài tập về tính nguyên tử khối trung bình, xác định phần trăm các đồng vị,..:
Nguyên tử khối
- Nguyên tử khối là khối lượng tương đối của nguyên tử.
- Nguyên tử khối của một nguyên tử cho biết khối lượng của nguyên tử đó nặng gấp bao nhiêu lần đơn vị khối lượng nguyên tử (1 amu).
- Một cách gần đúng, coi nguyên tử khối có giá trị bằng số khối.
Nguyên tử khối trung bình
- Mỗi nguyên tố thường có nhiều đồng vị, do đó trong thực tế người ta thường sử dụng giá trị nguyên tử khối trung bình.
- Muốn xác định giá trị nguyên tử khối trung bình của một nguyên tố, ta cần phải biết được phần trăm số nguyên tử các đồng vị của nguyên tố đó trong tự nhiên. Người ta thường dùng phương pháp phổ khối lượng để xác định phần trăm số nguyên tử các đồng vị tự nhiên của các nguyên tố.
- Công thức tính nguyên tử khối trung bình của nguyên tố X:
Trong đó:
: là nguyên tử khối trung bình của X
Ai: là nguyên tử khối đồng vị thứ i
ai: là tỉ lệ % số nguyên tử đồng vị thứ i
- Xác định phần trăm các đồng vị
Gọi % của đồng vị 1 là x %
⇒ % của đồng vị 2 là (100 – x).
- Lập phương trình tính nguyên tử khối trung bình ⇒ giải được x.
Cách 2: phương pháp giải nhanh sử dụng đường chéo để làm bài
Công thức tính phần trăm số nguyên tử mỗi đồng vị
Giả sử nguyên tố R có 2 hai đồng vị A và B với số khối tương ứng là A và B
a, b là phần trăm tương ứng của 2 đồng vị trong tự nhiên.
Ta có: a + b = 100 hay b = 100 – a.
Thay vào công thức tính nguyên tử khối trung bình:
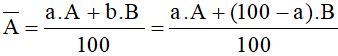
Từ đó giải ra được a và b.
Xem thêm các bài viết liên quan hay, chi tiết:
Lý thuyết Ôn tập chương 1 – Hóa 10 Kết nối tri thức
Trắc nghiệm Hạt nhân nguyên tử - Nguyên tố hóa học - Đồng vị có đáp án – Hóa học lớp 10
Câu 2:
14/07/2024Nguyên tử khối trung bình của Bo bằng 10,81u. Biết Bo có 2 đồng vị 105B và 115B. Hỏi có bao nhiêu phần trăm số nguyên tử đồng vị 105B trong axít H3BO3 ?
 Xem đáp án
Xem đáp án
Đáp án A
Giả sử % 10B và % 11B trong tự nhiên lần lượt là x, y.
Ta có hpt:
Vậy phần trăm số nguyên tử đồng vị 10B trong H3BO3 là
Câu 3:
08/07/2024Một nguyên tố R có 3 đồng vị X, Y ,Z; biết tổng số các hạt cơ bản (n, p, e) trong 3 đồng vị bằng 129, số nơtron đồng vị X hơn đồng vị Y một hạt. Đồng vị Z có số proton bằng số nơtron. Số khối của X, Y, Z lần lượt là
 Xem đáp án
Xem đáp án
Đáp án B
• Giả sử số hạt nơtron trong X, Y, Z lần lượt là NX, NY, NZ
Vì X, Y, Z là đồng vị nên chúng đều có số p = số e = Z
Ta có hpt:
→ 7Z + NY = 128.
• TH1: Z = 13.
→ NZ = 13, NX = 19,5; NY = 18,5 → loại.
• TH2: Z = 14
→ NZ = 14, NX = 16, NY = 15
→ Số khối của X, Y, Z lần lượt là 30, 29, 28
Câu 4:
21/07/2024Một lít khí hiđro giàu đơteri (12H) ở điều kiện tiêu chuẩn có khối lượng 0,10 gam. Cho rằng hiđro chỉ có hai đồng vị là 1H và 2H. Phần trăm khối lượng nguyên tử 1H trong loại khí hiđro trên là
 Xem đáp án
Xem đáp án
Đáp án D
Gọi số mol của 2 đồng vị lần lượt là a và b
Câu 5:
22/07/2024Nguyên tố O có 3 đồng vị 16O, 17O, 18O. Biết 752,875. 1020 nguyên tử oxi có khối lượng m gam. Tỷ lệ giữa các đồng vị lần lượt là 16O : 17O = 4504 : 301, 18 O : 17O = 585 : 903 . Tính giá trị của m
 Xem đáp án
Xem đáp án
Đáp án B
• 16O : 17O = 4504 : 301; 18O : 17O = 585 : 903 = 195 : 301
→ 16O : 17O : 18O = 4504 : 301 : 195
Phần trăm từng đồng vị của O là
Khối lượng trung bình nguyên tử O là:
MO = 16 x 0,9008 + 17 x 0,0602 + 18 x 0,039 = 16,1382
nO = 752,875. 1020 : (1,6023. 1023) = 0,125 mol
→ mO = 0,125 x 16,1382 = 2,017275 gam
Câu 6:
21/07/2024Trong tự nhiên sắt gồm 4 đồng vị 54Fe chiếm 5,8%, 56Fe chiếm 91,72%, 57Fe chiếm 2,2% và 58Fe chiếm 0,28%. Brom là hỗn hợp hai đồng vị 79Br chiếm 50,69% và 81Br chiếm 49,31%.
Thành phần % khối lượng của 56Fe trong FeBr3 là
 Xem đáp án
Xem đáp án
Đáp án A
• Khối lượng nguyên tử trung bình của Fe là
MFe = 0,058 x 54 + 0,9172 x 56 + 0,022 x 57 + 0,0028 x 58 = 55,9116.
Khối lượng trung bình của Br là
MBr = 0,5069 x 79 + 0,4931 x 81 = 79,9862.
Phần trăm khối lượng của 56Fe trong FeBr3 là
Câu 7:
21/10/2024Trong tự nhiên clo có hai đồng vị bền: 37Cl chiếm 24,23% tổng số nguyên tử, còn lại là 35Cl (Cl có số hiệu nguyên tử là 17).
Thành phần % theo khối lượng của 37Cl trong HClO4 là (Cho: H = 1, O = 16):
 Xem đáp án
Xem đáp án
Đáp án đúng: A
*Phương pháp giải:
- ta có đông vị 37Cl chiếm 24,23% từ đó sẽ tính ra được %đồng vị 35Cl
- tính khối lượng mol trung bình của Cl trong cả 2 đồng vị
- từ đó tính ra phần trắm của 37Cl trong HClO4
*Lời giải:
Phần trăm đồng vị là 24,23%
→ Phần trăm đồng vị là
100 – 24,23 = 75,77%
MCl = (g/mol)
Phần trăm khối lượng của trong HClO4 là:
% =
* Lý thuyết cần nắm và dạng bài tập về tính phần trắm đồng vị, tính nguyên tử khối trung bình:
Nguyên tử khối
- Nguyên tử khối là khối lượng tương đối của nguyên tử.
- Nguyên tử khối của một nguyên tử cho biết khối lượng của nguyên tử đó nặng gấp bao nhiêu lần đơn vị khối lượng nguyên tử (1 amu).
- Một cách gần đúng, coi nguyên tử khối có giá trị bằng số khối.
Áp dụng công thức tính nguyên tử khối trung bình:
Với: a, b, c là số nguyên tử (hoặc % số nguyên tử) của mỗi đồng vị.
A, B, C là nguyên tử khối (hay số khối) của mỗi đồng vị.
Xác định phần trăm các đồng vị
Gọi % của đồng vị 1 là x %
⇒ % của đồng vị 2 là (100 – x).
- Lập phương trình tính nguyên tử khối trung bình ⇒ giải được x.
Cách 2: phương pháp giải nhanh sử dụng đường chéo để làm bài
Xem thêm các bài viết liên quan hay, chi tiết:
Lý thuyết Ôn tập chương 1 – Hóa 10 Kết nối tri thức
Giải Hóa 10 Bài 4 (Kết nối tri thức): Ôn tập chương 1
Trắc nghiệm Hạt nhân nguyên tử - Nguyên tố hóa học - Đồng vị có đáp án – Hóa học lớp 10
Câu 8:
23/07/2024Bo có 2 đồng vị là 10B và 11B với nguyên tử khối trung bình là 10,81. Thành phần % về khối lượng của đồng vị 11B chứa trong H3BO3 là (Cho: H = 1, O = 16)
 Xem đáp án
Xem đáp án
Chọn đáp án C
Đặt phần trăm đồng vị \({}^{10}B\) = x (%), thì % đồng vị \({}^{11}B\) = 100 – x (%)
Ta có: A = \(\frac{{10x + 11(100 - x)}}{{100}} = 10,81\)
→ x = 19%
→ Phần trăm đồng vị \({}^{10}B\) là 19%;
Phần trăm đồng vị \({}^{11}B\) là 81%
Phần trăm khối lượng của \({}^{11}B\) trong H3BO3 là:
%\({m_{{}^{11}B}}\) = \(\frac{{11.81}}{{100.(3.1 + 10,81 + 16.3)}}\) .100 = 14,42%
Câu 9:
21/07/2024Trong tự nhiên nguyên tố Bo có hai đồng vị bền là 11B và 10B. Biết nguyên tử khối trung bình của Bo là 10,81. Trung bình cứ có 1539 nguyên tử 10B thì sẽ có tương ứng bao nhiêu nguyên tử 11B ?
 Xem đáp án
Xem đáp án
Đáp án D
• Giả sử % nguyên tử 11B và 10B trong tự nhiên lần lượt là x, y.
Ta có hpt:
Nếu có 1539 nguyên tử 10B thì có
nguyên tử 11B.
Câu 10:
23/07/2024Trong tự nhiên Mg có 3 đồng vị bền: 24Mg (79,00%); 25Mg (10,00%) và 26Mg (11,00%). Giả sử có 158 nguyên tử đồng vị 24Mg thì tổng số nguyên tử của hai đồng vị còn lại là
 Xem đáp án
Xem đáp án
Đáp án D
• Giả sử có 158 nguyên tử 24Mg thì
→ Tổng số nguyên tử của 25Mg và 26Mg là 20 + 22 = 42
Câu 11:
23/07/2024Trong tự nhiên lưu huỳnh gồm 4 đồng vị bền:
Thành phần % về khối lượng của đồng vị 32S trong H2SO4 có giá trị gần nhất với (H = 1; O = 16)
 Xem đáp án
Xem đáp án
Đáp án C
• Khối lượng nguyên tử trung bình của S là
MS = 0,9502 x 32 + 0,0075 x 33 + 0,0421 x 34 + 0,0002 x 36 = 32,0925
Phần trăm khối lượng của 32S trong H2SO4 là
Câu 12:
21/07/2024Số phân tử dạng A2B được tạo thành từ n đồng vị của A và m đồng vị của B là:
 Xem đáp án
Xem đáp án
Đáp án A
Giả sứ A có các đồng vị từ 1 A, 2A....nA
Giả sứ B có các đồng vị từ 1 B, 2B....mB
Phân tử có A2B có dạng ABA
Giả sử lấy 1 đồng vị của B ( cố định) kết hợp với n đồng vị của A
Chọn 1 A đứng đầu ta có 1 AB1 A, 1 AB2 A, ..... 1 ABn A → có n loại phân tử
Chọn 2 A đứng đầu có 2 A 2 A, 2 AB3 A,.... 2 ABn A → có n-1 loại phân tử
......................................................................
Chọn n A đứng dầu có n ABn A có 1 loại phân tử
Như vậy cứ n loại nguyên tử A kết hợp với 1 loai nguyên tử B có
1+ 2+ 3+.... + n =
Cứ n loại nguyên tử A kết hợp với m loai nguyên tử B có
Câu 13:
03/07/2024Trong tự nhiên oxi có 3 đồng vị là 16O, 17O, 18O ; nitơ có 2 đồng vị là 14N, 15N còn H có 3 đồng vị bền là 1H, 2H, 3H. Khẳng định nào sau đây là không đúng?
 Xem đáp án
Xem đáp án
Đáp án B
• Áp dụng công thức số phân tử dạng A2B được tạo thành từ n đồng vị của A và m đồng vị của B là
HNO3: Chọn H có 3 cách, chọn N có 2 cách, chọn OOO có 10 cách → có 60 phân tử dạng HNO3
Câu 14:
22/07/2024Trong tự nhiên clo có 2 đồng vị là 35Cl và 37Cl. Nguyên tử khối trung bình của clo là 35,5. Thành phần % khối lượng của 37Cl trong KClO3 là (Cho: K = 39, O = 16)
 Xem đáp án
Xem đáp án
Đáp án B
Đặt phần trăm đồng v = x (%),
thì % đồng vị = 100 – x (%)
Ta có: A =
→ x = 75%
→ Phần trăm đồng vị là 75%;
Phần trăm đồng vị là 25%
Phần trăm khối lượng của trong KClO3 là:
% = .100 = 7,55%
Câu 15:
22/07/2024Nguyên tố N có 2 đồng vị là 14N và 15N ; H có 3 đồng vị là 1H, 2H và 3H. Số phân tử NH3 tối đa có thể có là (biết 3 nguyên tử H trong NH3 là tương đương về mặt cấu tạo)
 Xem đáp án
Xem đáp án
Đáp án D
Chọn ra bộ ba nguyên tử H từ 3 đồng vị 1H; 2H; 3H có 10 cách chọn
(111, 112, 113, 122, 123,133, 222, 223, 233, 333).
ứng với mỗi bộ ba H, ghép 1 đồng vị N ta được một phân tử NH3 khác nhau.
Theo đó, với 2 đồng vị N thì có tối đa 2 × 10 = 20 phân tử NH3
Bài thi liên quan
-
Bài tập về Đồng vị nâng cao siêu hay có lời giải (P1)
-
15 câu hỏi
-
30 phút
-