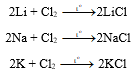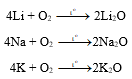Giải Hóa 12 Bài 24 (Kết nối tri thức): Nguyên tố nhóm IA
Với giải bài tập Hóa 12 Bài 24: Nguyên tố nhóm IA sách Kết nối tri thức hay nhất, chi tiết giúp học sinh dễ dàng làm bài tập Hóa 12 Bài 24.
Giải Hóa 12 Bài 24: Nguyên tố nhóm IA
Mở đầu trang 108 Hóa học 12: Các kim loại nhóm IA (nhóm kim loại kiềm) và hợp chất của chúng có nhiều ứng dụng như: sản xuất pin lithium, nước Javel, phân kali, tế bào quang điện, đồng hồ nguyên tử,...
Vậy, đơn chất nhóm IA có đặc điểm gì nổi bật về tính chất vật lí và tính chất hoá học? Các hợp chất nhóm IA quan trọng như xút, soda được sản xuất trong công nghiệp như thế nào?
Lời giải:
- Tính chất vật lí của đơn chất nhóm IA:
+ Trong nhóm IA, nhiệt độ nóng chảy và nhiệt độ sôi của các kim loại có xu hướng giảm dần từ Li đến Cs.
Các kim loại nhóm IA đều dễ nóng chảy và có nhiệt độ nóng chảy thấp hơn so với các kim loại nhóm khác.
+ Các kim loại nhóm IA có khối lượng riêng nhỏ (đều là kim loại nhẹ) do có bán kính nguyên tử lớn và cấu trúc mạng tinh thể kém đặc khít.
+ Do có liên kết kim loại yếu nên các kim loại nhóm IA có độ cứng thắp (đều mềm, có thể cắt bằng dao, kéo).
- Tính chất hoá học của đơn chất nhóm IA:
+ Kim loại kiềm là những kim loại hoạt động hoá học mạnh, có tính khử mạnh và tính khử tăng dần từ Li đến Cs.
+ Các kim loại kiềm có thể điện cực chuẩn rất âm, do đó chúng đều phản ứng với nước ở điều kiện thường với mức độ tăng dần từ Li đến Cs.
- Các hợp chất nhóm IA quan trọng như xút, soda được sản xuất trong công nghiệp như sau:
+ Trong công nghiệp, xút (NaOH) được điều chế bằng phương pháp điện phân dung dịch NaCl bão hoà, có màng ngăn điện cực.
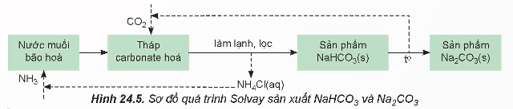
+ Trong công nghiệp, sodium hydrogencarbonate (baking soda) và sodium carbonate (soda) được sản xuất bằng phương pháp Solvay từ nguyên liệu chính là đá vôi, muối ăn, ammonia và nước.
Quá trình Solvay sản xuất soda gồm hai giai đoạn chính:
Giai đoạn tạo NaHCO3:
NaCl + NH3 + CO2 + H2O ⇌ NaHCO3 + NH4Cl
Khi làm lạnh, NaHCO3 kết tinh và được lọc, tách khỏi hệ phản ứng.
Giai đoạn tạo Na2CO3:
2NaHCO3 Na2CO3 + CO2 + H2O
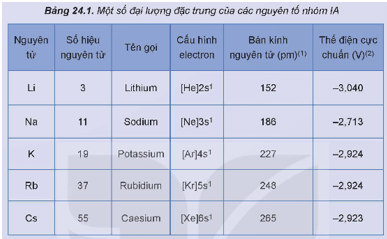
Hoạt động trang 109 Hóa học 12: Một số đại lượng đặc trưng của các nguyên tố nhóm IA được trình bày trong Bảng 24.1:
Thực hiện các yêu cầu sau:
1. Nhận xét về xu hướng biến đổi bán kính nguyên tử của nguyên tố nhóm IA.
2. Cho biết: xu hướng biến đổi tính khử từ Li đến Cs; số oxi hoá đặc trưng của nguyên tử kim loại nhóm IA.
Lời giải:
1. Trong nhóm IA, theo chiều từ trên xuống dưới (chiều tăng dần của điện tích hạt nhân) bán kính nguyên tử tăng dần.
2. Dựa vào thế điện cực chuẩn xác định được từ Li đến Cs tính khử của kim loại tăng dần;
Do nguyên tố nhóm IA là những nguyên tố s, chỉ có 1 electron hoá trị ở phân lớp ns1 nên số oxi hoá đặc trưng của nguyên tử kim loại nhóm IA trong hợp chất là +1.
Câu hỏi 1 trang 109 Hóa học 12: Tại sao các nguyên tố kim loại nhóm IA không tồn tại ở dạng đơn chất trong tự nhiên?
Lời giải:
Kim loại nhóm IA có thế điện cực chuẩn rất nhỏ nên dễ tách electron hoá trị ra khỏi nguyên tử. Do đó, nguyên tố kim loại nhóm IA không tồn tại ở dạng đơn chất trong tự nhiên.
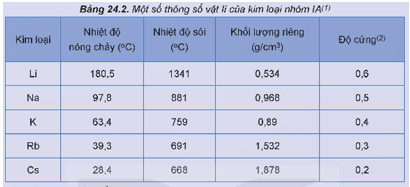
Hoạt động trang 110 Hóa học 12: Một số thông số vật lí của kim loại nhóm IA được trình bày ở Bảng 24.2:
Thực hiện các yêu cầu sau:
1. Nhận xét về xu hướng biến đổi nhiệt độ nóng chảy, nhiệt độ sôi của các kim loại nhóm IA.
2. Dựa vào Bảng 24.2, hãy nhận xét về khối lượng riêng và độ cứng của các kim loại nhóm IA.
Lời giải:
1. Trong nhóm IA, nhiệt độ nóng chảy và nhiệt độ sôi của các kim loại có xu hướng giảm dần từ Li đến Cs.
Các kim loại nhóm IA đều dễ nóng chảy và có nhiệt độ nóng chảy thấp hơn so với các kim loại nhóm khác.
2. Các kim loại nhóm IA có khối lượng riêng nhỏ (đều là kim loại nhẹ) do có bán kính nguyên tử lớn và cấu trúc mạng tinh thể kém đặc khít.
Do có liên kết kim loại yếu nên các kim loại nhóm IA có độ cứng thắp (đều mềm, có thể cắt bằng dao, kéo).
Hoạt động trang 111 Hóa học 12: Lithium, sodium, potassium tác dụng với nước, chlorine, oxygen
Ba thí nghiệm về phản ứng của lithium, sodium, potassium với nước, chlorine, oxygen đã được thực hiện và quan sát thấy các hiện tượng như được mô tả dưới đây:
Hoá chất: kim loại lithium, sodium, potassium, nước.
Dụng cụ: 3 bình tam giác đựng khí oxygen, 3 bình tam giác đựng khí chlorine, 3 chậu thuỷ tinh, muôi sắt, dao, kẹp sắt.
Thí nghiệm 1: Tác dụng với nước
Tiến hành:
Cho mỗi mẩu kim loại vào một chậu thuỷ tinh chứa nước, hiện tượng xảy ra được ghi lại ở Bảng 24.3.
Thực hiện các yêu cầu sau:
1. So sánh mức độ phản ứng của Li, Na, K với nước.
2. Viết phương trình hoá học của các phản ứng xảy ra. Nêu cách nhận biết môi trường của các dung dịch sau phản ứng.
Thí nghiệm 2: Tác dụng với chlorine
Tiến hành:
Cho mỗi mẩu kim loại Li, Na, K vào một muôi sắt, hơ nóng trên ngọn lửa đèn cồn đến khi nóng chảy, rồi đưa nhanh vào bình đựng khí chlorine.
Hiện tượng xảy ra như sau: Các kim loại bốc cháy với mức độ tăng dần từ Li đến K. Thực hiện yêu cầu sau:
Viết phương trình hoá học của các phản ứng xảy ra.
Thí nghiệm 3: Tác dụng với oxygen
Tiến hành:
Cho mỗi mẩu kim loại Li, Na, K vào một muôi sắt, hơ nóng trên ngọn lửa đèn cồn đến khi nóng chảy rồi đưa nhanh vào lọ đựng khí oxygen.
Hiện tượng xảy ra như sau: Các kim loại bốc cháy với mức độ tăng dần từ Li đến K.
Thực hiện yêu cầu sau:
Viết phương trình hoá học của các phản ứng xảy ra.
Lời giải:
1. Các kim loại kiềm phản ứng mạnh với nước, mức độ phản ứng tăng dần theo chiều: Li, Na, K.
2. Phương trình hoá học của phản ứng xảy ra:
2Li + 2H2O → 2LiOH + H2
2Na + 2H2O → 2NaOH + H2
2K + 2H2O → 2KOH + H2
Để nhận biết môi trường của các dung dịch sau phản ứng có thể dùng các chất chỉ thị như quỳ tím, phenolphthalein.
Thí nghiệm 2:
Các phương trình hoá học của phản ứng xảy ra:
Thí nghiệm 3:
Các phương trình hoá học của phản ứng xảy ra:
Câu hỏi 2 trang 112 Hóa học 12: Trong phòng thí nghiệm:
a) Khi kim loại nhóm IA (Li, Na, K) tác dụng với nước thì cần lấy mẩu kim loại nhỏ. Giải thích.
b) Sodium được dùng để loại nước khỏi một số dung môi hữu cơ như ether. Giải thích.
Lời giải:
a) Kim loại nhóm IA có thế điện cực chuẩn rất nhỏ nên phản ứng mãnh liệt với nước do đó chỉ cần lấy mẩu kim loại nhỏ đã đủ để quan sát thí nghiệm. Ngoài ra, để đảm bảo an toàn khi tiến hành thí nghiệm chỉ cần lấy mẩu kim loại nhỏ.
b) Sodim tác dụng dễ dàng với nước nhưng không tác dụng với một số dung môi hữu cơ như ether, do đó trong phòng thí nghiệm sodium được dùng để loại nước khỏi một số dung môi hữu cơ như ether.
Câu hỏi 3 trang 112 Hóa học 12:
a) Tại sao có thể bảo quản Na, K bằng cách ngâm trong dầu hoả?
b) Có thể sử dụng alcohol (ví dụ ethanol) để bảo quản kim loại nhóm IA không? Giải thích.
Lời giải:
a) Kim loại nhóm IA dễ tác dụng với hơi nước, với oxygen có trong không khí nên trong phòng thí nghiệm Na và K thường được bảo quản trong dầu hoả.
b) Không thể sử dụng alcohol (ví dụ ethanol) để bảo quản kim loại nhóm IA. Do alcohol có thể tác dụng được với kim loại nhóm IA. Ví dụ:
2C2H5OH + 2Na → 2C2H5ONa + H2
Hoạt động trang 112 Hóa học 12: Phân biệt Li+, Na+, K+ bằng ngọn lửa (học sinh quan sát video thí nghiệm)
Hoá chất: các dung dịch bão hoà: LiCl, NaCl, KCl.
Dụng cụ: ống nghiệm, giá ống nghiệm, dây platinum (hoặc nickel); đèn khí Bunsen (khí gas).
Tiến hành:
- Nhúng dây platinum vào ống nghiệm chứa dung dịch LiCl bão hoà.
- Hơ nóng đầu dây trên ngọn lửa đèn khí.
- Tiến hành thí nghiệm tương tự với dung dịch NaCl bão hoà và dung dịch KCl bão hoà.
Quan sát hiện tượng xảy ra qua video thí nghiệm và thực hiện yêu cầu sau:
Nhận xét về màu ngọn lửa các ion kim loại trong thí nghiệm.
Lời giải:
Ở nhiệt độ thường, các ion kim loại nhóm IA đều không có màu. Tuy nhiên, đốt nóng hợp chất của chúng trên ngọn lửa không màu làm ngọn lửa có màu đặc trưng:
+ Hợp chất của Li: ngọn lửa có màu đỏ tía;
+ Hợp chất của Na: ngọn lửa có màu vàng;
+ Hợp chất của K: ngọn lửa có màu tím.
Hoạt động trang 113 Hóa học 12: Viết các quá trình oxi hoá, quá trình khử xảy ra ở mỗi điện cực và viết phương trình hoá học của quá trình điện phân dung dịch NaCl có màng ngăn.
Lời giải:
Quá trình oxi hoá, quá trình khử xảy ra ở mỗi điện cực:
Tại anode:
Tại cathode:
Phương trình hoá học của phản ứng điện phân:
Hoạt động 1 trang 114 Hóa học 12: NaHCO3 là hợp chất kém bền nhiệt, bắt đầu bị phân huỷ ở khoảng 120 oC:
2NaHCO3(s) Na2CO3(s) + CO2(g) + H2O (g)
Trong thực tiễn, NaHCO3 được sử dụng làm bột nở trong chế biến thực phẩm và làm chất chữa cháy dạng bột. Giải thích cơ sở của các ứng dụng đó.
Lời giải:
- Trong chế biến thực phẩm, NaHCO3 được sử dụng làm bột nở do khi nướng bánh hoặc hấp bánh … NaHCO3 phân huỷ giải phóng CO2 làm bánh phồng, xốp.
- Trong chữa cháy, NaHCO3 được dùng làm chất chữa cháy dạng bột do ở nhiệt độ cao NaHCO3 phân huỷ giải phóng CO2, khí này không duy trì sự cháy có tác dụng làm loãng oxygen. Ngoài ra, Na2CO3 sinh ra còn có tác dụng ngăn cách vật cháy với oxygen không khí giúp dập tắt đám cháy.
Hoạt động 2 trang 114 Hóa học 12: Viết các phương trình hoá học để giải thích cơ sở các ứng dụng sau:
a) Viên sủi chứa NaHCO3 và acid hữu cơ (viết gọn là HX) có khả năng tạo bọt khí khi hoà tan vào nước.
b) Trong kĩ thuật xử lí nước, NaHCO3 được dùng để điều chỉnh pH khi nước dư acid (H+).
Lời giải:
Các phương trình hoá học:
a) NaHCO3 + HX → NaX + CO2 + H2O;
Hoạt động trang 114 Hóa học 12: Trong thực tiễn, sodium carbonate có một số ứng dụng.
1. Tách loại ion Mg2+ và Ca2+ ra khỏi nước (để làm mềm nước).
2. Tách loại ion Fe3+ ra khỏi nước ở dạng kết tủa Fe(OH)3 (để xử lí nước nhiễm phèn).
Viết phương trình hoá học để giải thích các ứng dụng trên.
Lời giải:
Trong dung dịch:
Phương trình hoá học để giải thích các ứng dụng:
Câu hỏi 4 trang 115 Hóa học 12:
a) Trong quá trình Solvay viết các phương trình hoá học của phản ứng:
- Nung vôi để cung cấp vôi sống và carbon dioxide.
- Tái chế ammonia từ vôi sống và dung dịch ammonium chloride.
b) Quy trình Solvay đã giảm thiểu được tác động đến môi trường bằng cách quay vòng các sản phẩm trung gian (như CO2 và NH3) để tái sử dụng trong quy trình sản xuất.
Từ sơ đồ quá trình Solvay, hãy làm sáng tỏ nhận định trên.
Lời giải:
a) Trong quá trình Solvay viết các phương trình hoá học của phản ứng:
- Nung vôi để cung cấp vôi sống và carbon dioxide:
CaCO3 CaO + CO2
- Tái chế ammonia từ vôi sống và dung dịch ammonium chloride.
CaO + H2O → Ca(OH)2
Ca(OH)2 + 2NH4Cl → CaCl2 + 2NH3↑ + 2H2O
Hoặc có thể viết gọn:
2NH4Cl + CaO → 2NH3 + CaCl2 + H2O
b) Quy trình Solvay đã giảm thiểu được tác động đến môi trường bằng cách quay vòng các sản phẩm trung gian (như CO2 và NH3) để tái sử dụng trong quy trình sản xuất.
Từ sơ đồ quá trình Solvay, ta có quá trình cụ thể như sau:
(1) Hoà tan NaCl vào dung dịch NH3 đặc đến bão hoà.
(2) Nung CaCO3, rồi dẫn khí thoát ra vào dung dịch bão hoà của NaCl trong NH3:
CaCO3 CaO + CO2
NaCl + NH3 + CO2 + H2O NaHCO3 + NH4Cl
(3) Do NaHCO3 ít tan hơn các muối khác nên kết tinh trước. Tách NaHCO3 ra khỏi dung dịch, nung ở nhiệt độ cao được soda:
2NaHCO3 Na2CO3 + CO2 + H2O
(4) Sản phẩm NH4Cl được chế hoá bởi vôi tôi, thu khí NH3:
2NH4Cl + Ca(OH)2 → CaCl2 + 2NH3 + 2H2O
Các khí CO2, NH3 được đưa vào sử dụng lại. NH3 được tuần hoàn trong quá trình sản xuất.
Em có thể trang 115 Hóa học 12:
- Bảo quản kim loại kiềm đúng cách.
- Giải thích được cơ sở của quá trình sản xuất chlorine – kiềm, quá trình Solvay.
Lời giải:
- Các kim loại kiềm thường dược bảo quản bằng cách ngâm trong dầu hoả, trong chân không hoặc trong khí hiếm.
- Sodium chloride là nguyên liệu sản xuất chlorine, kiềm bằng phương pháp điện phân dung dịch;
- Sodium hydrogencarbonate và sodium carbonate được sản xuất bằng phương pháp Solvay. Quy trình Solvay đã giảm thiểu được tác động đến môi trường bằng cách quay vòng các sản phẩm trung gian (như CO2 và NH3) để tái sử dụng trong quy trình sản xuất.
Xem thêm các chương trình khác:
- Soạn văn 12 Kết nối tri thức (hay nhất)
- Văn mẫu 12 - Kết nối tri thức
- Tóm tắt tác phẩm Ngữ văn 12 – Kết nối tri thức
- Tác giả tác phẩm Ngữ văn 12 - Kết nối tri thức
- Bố cục tác phẩm Ngữ văn 12 – Kết nối tri thức
- Nội dung chính tác phẩm Ngữ văn 12 – Kết nối tri thức
- Giải sgk Toán 12 – Kết nối tri thức
- Giải Chuyên đề học tập Toán 12 – Kết nối tri thức
- Lý thuyết Toán 12 – Kết nối tri thức
- Giải sbt Toán 12 – Kết nối tri thức
- Bài tập Tiếng Anh 12 Global success theo Unit có đáp án
- Giải sgk Tiếng Anh 12 - Global success
- Trọn bộ Từ vựng Tiếng Anh 12 Global success đầy đủ nhất
- Trọn bộ Ngữ pháp Tiếng Anh 12 Global success đầy đủ nhất
- Giải sbt Tiếng Anh 12 – Global Success
- Giải sgk Vật lí 12 – Kết nối tri thức
- Giải Chuyên đề học tập Vật lí 12 – Kết nối tri thức
- Lý thuyết Vật lí 12 – Kết nối tri thức
- Giải sbt Vật lí 12 – Kết nối tri thức
- Giải sgk Sinh học 12 – Kết nối tri thức
- Giải Chuyên đề học tập Sinh học 12 – Kết nối tri thức
- Lý thuyết Sinh học 12 – Kết nối tri thức
- Giải sbt Sinh học 12 – Kết nối tri thức
- Giải sgk Lịch sử 12 – Kết nối tri thức
- Giải Chuyên đề học tập Lịch sử 12 – Kết nối tri thức
- Giải sbt Lịch sử 12 – Kết nối tri thức
- Giải sgk Địa lí 12 – Kết nối tri thức
- Giải Chuyên đề học tập Địa lí 12 – Kết nối tri thức
- Giải sbt Địa lí 12 – Kết nối tri thức
- Giải sgk Tin học 12 – Kết nối tri thức
- Giải Chuyên đề học tập Tin học 12 – Kết nối tri thức
- Giải sbt Tin học 12 – Kết nối tri thức
- Lý thuyết Tin học 12 - Kết nối tri thức
- Giải sgk Công nghệ 12 – Kết nối tri thức
- Giải sgk Kinh tế pháp luật 12 – Kết nối tri thức
- Giải Chuyên đề học tập Kinh tế pháp luật 12 – Kết nối tri thức
- Giải sbt Kinh tế pháp luật 12 – Kết nối tri thức
- Giải sgk Giáo dục quốc phòng 12 – Kết nối tri thức
- Giải sgk Hoạt động trải nghiệm 12 – Kết nối tri thức