Câu hỏi:
02/11/2024 2,622Việc sản xuất amoniac trong công nghiệp dựa trên phản ứng :
N2 (k) + 3H2 (k) ⇄ 2NH3 (k)  < 0.
< 0.
Muốn sản xuất amoniac đạt hiệu quả cao, người ta phải thay đổi các yếu tố nào sau đây ?
</>
A. Tăng nhiệt độ và cho chất xúc tác.
B. Giảm áp suất và tăng nồng độ NH3.
C. Điều chỉnh để nồng độ N2bằng nồng độ H2.
D. Tăng áp suất, giảm nhiệt độ và lấy NH3ra khỏi phản ứng.
Trả lời:
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án đúng là: D
- Muốn sản xuất amoniac đạt hiệu quả cao, người ta phải thay đổi các yếu tố Tăng áp suất, giảm nhiệt độ và lấy NH3ra khỏi phản ứng.
Khi tăng áp suất, cân bằng chuyển dịch theo chiều làm giảm áp suất (chiều thuận)
Khi giảm nhiệt độ, cân bằng chuyển dịch theo chiều làm tăng nhiệt độ (chiều thuận)
Lấy NH3ra khỏi phản ứng, cân bằng chuyền dịch theo chiều làm tăng NH3(chiều thuận).
→ D đúng.A,B,C sai.
* Phản ứng một chiều
- Phản ứng một chiều là phản ứng chỉ xảy ra theo một chiều từ trái sang phải (tức các sản phẩm phản ứng không tác dụng được với nhau để tạo ra các chất tham gia phản ứng).
- Ví dụ phản ứng một chiều:
2KClO3 2KCl + 3O2 ↑
Cũng điều kiện đó O2 tạo ra không tác dụng được với KCl để tạo thành KClO3.
2. Phản ứng thuận nghịch
- Phản ứng thuận nghịch là phản ứng xảy ra theo hai chiều trái ngược nhau (tức là các chất tham gia phản ứng tác dụng với nhau để tạo thành sản phẩm đồng thời các sản phẩm phản ứng được với nhau để tạo ra các chất tham gia phản ứng).
Ví dụ phản ứng thuận nghịch:
3H2 + N2 2NH3
NH3 được tạo thành đồng thời lại bị phân hủy sinh ra H2 và N2 là các chất tham gia phản ứng.
3. Cân bằng hóa học
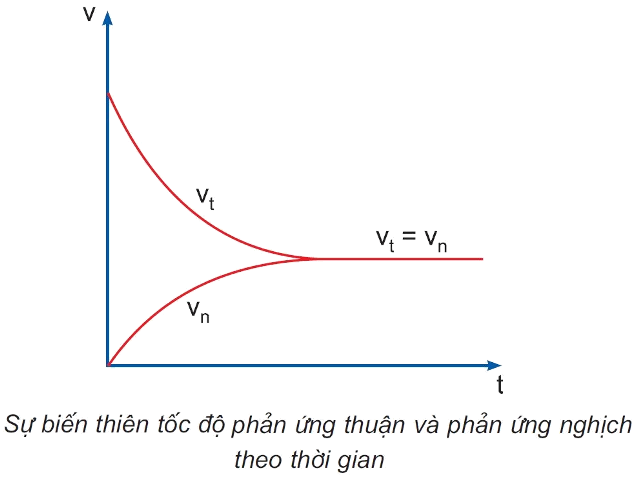
- Cân bằng hóa học là trạng thái của phản ứng thuận nghịch khi tốc độ phản ứng thuận bằng tốc độ của phản ứng nghịch.
- Cân bằng hóa học là cân bằng động, vì ở trạng thái cân bằng, phản ứng không dừng lại mà phản ứng thuận và phản ứng nghịch vẫn diễn ra, nhưng với tốc độ bằng nhau.
II. Sự chuyển dịch cân bằng hóa học
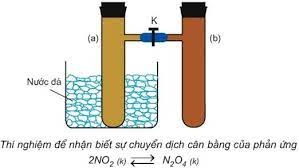
- Sự chuyển dịch cân bằng hóa học là sự chuyển từ trạng thái cân bằng này sang trạng thái cân bằng khác do tác động của các yếu tố từ bên ngoài lên cân bằng.
III. Các yếu tố ảnh hưởng đến cân bằng hóa học
1. Ảnh hưởng của nồng độ
- Khi tăng hoặc giảm nồng độ của một chất trong cân bằng thì cân bằng chuyển dịch theo chiểu làm giảm tác dụng của việc tăng hoặc giảm nồng độ của chất đó.
- Lưu ý: Đối với hệ cân bằng có chất rắn thì việc thêm hay bớt lượng chất rắn không ảnh hưởng đến cân bằng, nghĩa là cân bằng không chuyển dịch.
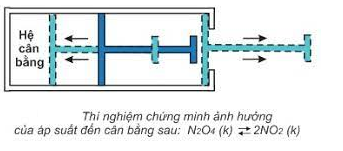
2. Ảnh hưởng của áp suất
- Khi tăng hoặc giảm áp suất chung của hệ cân bằng thì cân bằng chuyển dịch theo chiều làm giảm tác dụng của việc tăng hoặc giảm áp suất đó.
- Lưu ý: Khi hệ cân bằng có số mol khí ở 2 về bằng nhau hoặc trong hệ không có chất khí thì việc tăng, giảm áp suất chung của hệ không làm cho cân bằng chuyển dịch.
3. Ảnh hưởng của nhiệt độ
- Khi tăng nhiệt độ thì cân bằng chuyền dịch theo chiều phản ứng thu nhiệt, nghĩa là làm giảm tác dụng của việc tăng nhiệt độ.
- Còn khi giảm nhiệt độ thì cân bằng chuyển dịch theo chiều phản ứng tỏa nhiệt, nghĩa là làm giảm tác dụng của việc giảm nhiệt độ.
Kết luận: Nguyên lí chuyển dịch cân bằng (Nguyên lí Lơ Sa-tơ-li-ê): "Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu một tác động bên ngoài, như biến đổi nồng độ, áp suất, nhiệt độ sẽ chuyển dịch cân bằng theo chiều làm giảm tác động bên ngoài đó”.
4. Vai trò của chất xúc tác
- Chất xúc tác không ảnh hưởng đến cân bằng vì chất xúc tác làm tăng tốc độ phản ứng thuận và tốc độ phản ứng nghịch với số lần bằng nhau.
V. Ý nghĩa của tốc độ phản ứng và cân bằng hóa học trong sản xuất hóa học
Trong công nghiệp và sản xuất việc vận dụng các yếu tố làm tăng tốc độ phản ứng và chuyển dịch cân bằng giúp phản ứng thực hiện nhanh và đạt hiệu suất cao.
Xem thêm các bài viết liên quan,chi tiết khác:
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 1:
Cho các dung dịch: NaF, NaCl, NaBr, NaI. Chỉ dùng một thuốc thử nào sau đây để nhận biết được các dung dịch trên?
Câu 2:
Khi đốt cháy axetilen để hàn, cắt kim loại. Nhiệt lượng giải phóng ra lớn nhất khi axetilen
Câu 3:
Khi lần lượt tác dụng với mỗi chất dưới đây, trường hợp axit sunfuric đặc và axit sunfuric loãng hình thành sản phẩm giống nhau là
Câu 5:
Ở điều kiện thường (25oC, 1 atm), trạng thái tồn tại của lưu huỳnh là
Câu 6:
Để vận chuyển axit sunfuric đặc, nguội có thể đựng trong bình chứa làm bằng
Câu 7:
Sự dịch chuyển cân bằng hoá học là sự di chuyển từ trạng thái cân bằng hoá học này sang trạng thái cân bằng hoá học khác do
Câu 8:
Đưa mảnh giấy lọc tẩm dung dịch KI và hồ tinh bột vào bình đựng khí ozon, hiện tượng gì xuất hiện trên giấy lọc?
Câu 9:
Hòa tan hoàn toàn 7,8 gam hỗn hợp X gồm Al và Mg trong dung dịch HCl dư thu được 8,96 lít khí H2(đktc) và dung dịch chứa m gam muối. Thành phần phần trăm theo khối lượng của Mg trong X là
Câu 10:
Khi bắt đầu phản ứng, nồng độ một chất là 0,024 mol/l. Sau 10 giây xảy ra phản ứng, nồng độ của chất đó là 0,022 mol/l. Tốc độ phản ứng trong trường hợp này là
Câu 11:
Hấp thụ 2,24 lít khí SO2(đktc) vào 300 ml dung dịch NaOH 1M, thu được dung dịch X. Chất tan trong X là
Câu 12:
Dẫn V lít khí SO2(đktc) vào lượng dư dung dịch Br2, thu được dung dịch X. Cho dung dịch BaCl2dư vào X, thu được 23,3 gam kết tủa. Giá trị của V là
Câu 13:
Cho các ứng dụng sau :
(a) Được dùng để sát trùng, làm sạch nước sinh hoạt.
(b) Được dùng để chữa sâu răng.
(c) Được dùng để tẩy trắng tinh bột, dầu ăn.
(d) Được dùng để bảo quản trái cây chín.
Số ứng dụng trên của ozon là


