Câu hỏi:
05/12/2024 4,750Tương tác van der Waals là lực tương tác yếu giữa các phân tử, được hình thành do sự xuất hiện của các
A. ion âm và ion dương
B. lưỡng cực tạm thời
C. lưỡng cực cảm ứng
D. Cả B và C.
Trả lời:
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án đúng là: D
- Tương tác van der Waals là lực tương tác yếu giữa các phân tử, được hình thành do sự xuất hiện của các lưỡng cực tạm thời và lưỡng cực cảm ứng
- Tương tác van der Waals gồm 3 loại lực chính
+ Lực hút lưỡng cực - lưỡng cực:
Xuất hiện giữa các phân tử có lưỡng cực vĩnh cửu (như HCl, H2O).
Lưỡng cực vĩnh cửu là hiện tượng trong đó một phân tử có sự phân bố điện tích không đồng đều, tạo ra hai cực (dương và âm).
Các phân tử này sẽ hút nhau nhờ sự tương tác giữa cực dương của phân tử này với cực âm của phân tử kia.
+ Lực hút lưỡng cực cảm ứng:
Xảy ra khi một phân tử có lưỡng cực vĩnh cửu làm cảm ứng tạo ra lưỡng cực tạm thời trong phân tử không có lưỡng cực (ví dụ giữa HCl và O2).
Phân tử ban đầu với lưỡng cực vĩnh cửu sẽ làm dịch chuyển điện tích trong phân tử không có lưỡng cực, tạo nên lực hút.
+ Lực hút lưỡng cực tạm thời (lực London):
Đây là loại lực phổ biến nhất và yếu nhất, xảy ra giữa mọi phân tử, ngay cả các phân tử không phân cực (như khí hiếm, O2, N2).
Nguyên nhân: Do sự dao động ngẫu nhiên của các electron, một lưỡng cực tạm thời hình thành ở một phân tử và tạo ra lực cảm ứng ở các phân tử lân cận.
→ D đúng.A,B,C sai
* Tương tác van der Waals
Giữa các phân tử thậm chí không có liên kết hydrogen thì vẫn có tương tác với nhau, mặc dù yếu hơn. Đó là tương tác van der Waals.
1. Khái niệm
- Tương tác van der Waals là một loại liên kết yếu, hình thành do tương tác hút tĩnh điện giữa các cực trái dấu của phân tử.
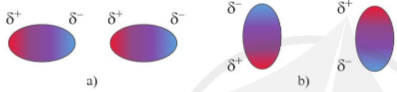
Hình 12.3. Các khả năng tương tác hút tĩnh điện giữa các cực trái dấu của hai phân tử
- Liên kết cộng hóa trị có cực là nguyên nhân dẫn tới sự phân cực ở các phân tử HCl, SO2, ...
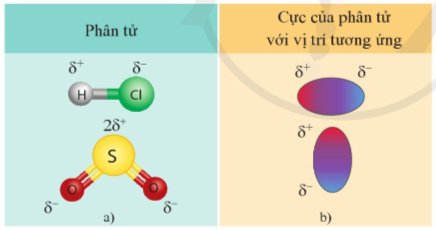
Hình 12.4. Một số phân tử có cực (a) và biểu diễn các cực của phân tử (b)
- Mặc dù có lực liên kết rất yếu, nhưng tương tác van der Waals lại có nhiều ảnh hưởng đến thực tiễn. Ví dụ: sự bám hút của các hạt bụi lên bề mặt nhẵn, sự hấp phụ các phân tử chất màu và chất độc hại trong nước bởi than hoạt tính, ...
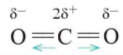
Lưu ý: Phân tử CO2 không có cực, mặc dù liên kết C=O trong phân tử là liên kết có cực. Lí do bởi phân tử này có dạng thẳng, hai liên kết C=O lại có cực ngược chiều nhau nên triệt tiêu lẫn nhau khi xét cho cả phân tử
2. Ảnh hưởng của tương tác van der Waals tới tính chất vật lí của các chất
- Tương tự như liên kết hydrogen, tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi các chất, nhưng ở mức độ ảnh hưởng yếu hơn so với liên kết hydrogen.
Xem thêm các bài viết liên quan,chi tiết khác:
Lý thuyết Hóa học 10 Bài 12: Liên kết hydrogen và tương tác Van Der Waals
Giải bài tập Hóa lớp 10 Bài 12: Liên kết hydrogen và tương tác Van Der Waals
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 2:
Trong dung dịch NH3 (hỗn hợp NH3 và H2O) tồn tại số loại liên kết hydrogen là
Câu 3:
Bản chất hình thành liên kết hydrogen và tương tác van der waals đều do
Câu 4:
Trong phân tử, khi các electron di chuyển tập trung về một phía bất kì của phân tử sẽ hình thành nên các
Câu 8:
Một phân tử nước có thể tạo liên kết hydrogen tối đa với bao nhiêu phân tử nước khác?
Câu 12:
Loại liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn, thường là F, O, N) với một nguyên tử khác (có độ âm điện lớn thường là F, O, N) còn cặp electron hóa trị chưa tham gia liên kết là


