Câu hỏi:
23/07/2024 284
Theo em, dạng hình học nào sau đây của hai phân tử carbon dioxide và nước là đúng?
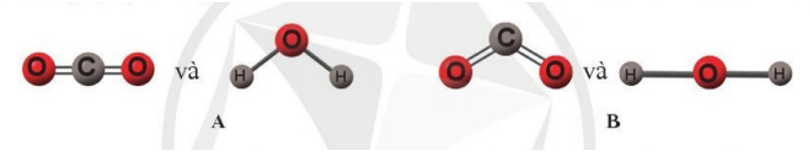
Theo em, dạng hình học nào sau đây của hai phân tử carbon dioxide và nước là đúng?
Trả lời:
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án A
Đối với phân tử CO2
Công thức Lewis của CO2 là
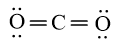
Nguyên tử trung tâm C có 2 liên kết (đôi) xung quanh tương ứng với 2 đám mây electron hóa trị. Công thức VSEPR của CO2 là AE2
Do 2 đám mây electron (liên kết đôi nối với O) phân bố thẳng hàng với nguyên tử C nên phân tử CO2 có dạng thẳng.
Đối với phân tử H2O
Công thức Lewis của H2O là
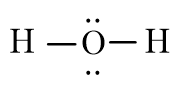
Xung quanh nguyên tử trung tâm O có 4 đám mây E (hai cặp electron chưa liên kết và hai cặp electron chung). Chiếm 4 khu vực điện tích âm đẩy nhau để góc hóa trị lớn nhất là 109,5o.
Tuy nhiên, do cặp electron chưa liên kết chiếm khoảng không gian lớn hơn so với các cặp electron liên kết, tương tác đẩy giữa các cặp electron chưa liên kết lớn hơn tương tác đẩy giữa các cặp electron liên kết, nên góc liên kết ^HOH thực tế bằng 104,5o, nhỏ hơn góc hóa trị theo lí thuyết (109,5o). Phân tử có dạng góc.
Đáp án A
Đối với phân tử CO2
Công thức Lewis của CO2 là
Nguyên tử trung tâm C có 2 liên kết (đôi) xung quanh tương ứng với 2 đám mây electron hóa trị. Công thức VSEPR của CO2 là AE2
Do 2 đám mây electron (liên kết đôi nối với O) phân bố thẳng hàng với nguyên tử C nên phân tử CO2 có dạng thẳng.
Đối với phân tử H2O
Công thức Lewis của H2O là
Xung quanh nguyên tử trung tâm O có 4 đám mây E (hai cặp electron chưa liên kết và hai cặp electron chung). Chiếm 4 khu vực điện tích âm đẩy nhau để góc hóa trị lớn nhất là 109,5o.
Tuy nhiên, do cặp electron chưa liên kết chiếm khoảng không gian lớn hơn so với các cặp electron liên kết, tương tác đẩy giữa các cặp electron chưa liên kết lớn hơn tương tác đẩy giữa các cặp electron liên kết, nên góc liên kết ^HOH thực tế bằng 104,5o, nhỏ hơn góc hóa trị theo lí thuyết (109,5o). Phân tử có dạng góc.
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 2:
Trình bày sự hình thành lai hóa sp3 của nguyên tử C trong CH4 và hình thành các liên kết trong phân tử này.
Trình bày sự hình thành lai hóa sp3 của nguyên tử C trong CH4 và hình thành các liên kết trong phân tử này.
Câu 5:
Xác định công thức Lewis của nitric acid HNO3. Cho biết nguyên tử H liên kết với O mà không phải với N.
Xác định công thức Lewis của nitric acid HNO3. Cho biết nguyên tử H liên kết với O mà không phải với N.
Câu 7:
Viết công thức Lewis và xác định dạng hình học của CS2. Xác định dạng lai hóa của nguyên tử trung tâm C trong phân tử này.
Viết công thức Lewis và xác định dạng hình học của CS2. Xác định dạng lai hóa của nguyên tử trung tâm C trong phân tử này.
Câu 8:
Dựa theo công thức Lewis của CHCl3 xác định được dạng lai hóa của nguyên tử trung tâm C trong phân tử này là
A. sp B. sp2 C. sp3
Dựa theo công thức Lewis của CHCl3 xác định được dạng lai hóa của nguyên tử trung tâm C trong phân tử này là
A. sp B. sp2 C. sp3
Câu 9:
Viết công thức Lewis của H2O. Dự đoán dạng hình học phân tử và dạng lai hóa của nguyên tử trung tâm.
Viết công thức Lewis của H2O. Dự đoán dạng hình học phân tử và dạng lai hóa của nguyên tử trung tâm.
Câu 11:
Phân tử acetone có dạng tam giác phẳng theo mô hình VSEPR. Xác định dạng lai hóa của nguyên tử trung tâm X. Biết công thức của acetone là
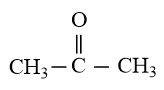
Phân tử acetone có dạng tam giác phẳng theo mô hình VSEPR. Xác định dạng lai hóa của nguyên tử trung tâm X. Biết công thức của acetone là
Câu 12:
Nguyên tử C trong CO2 có dạng lai hóa gì? Trình bày sự hình thành dạng lai hóa đó.
Nguyên tử C trong CO2 có dạng lai hóa gì? Trình bày sự hình thành dạng lai hóa đó.
Câu 13:
Giải thích vì sao khi xung quanh nguyên tử trung tâm có 3 đám mây electron hóa trị E thì 3 đám mây này có xu hướng nằm ở 3 đỉnh của một tam giác phẳng.
Giải thích vì sao khi xung quanh nguyên tử trung tâm có 3 đám mây electron hóa trị E thì 3 đám mây này có xu hướng nằm ở 3 đỉnh của một tam giác phẳng.
Câu 15:
Đặc điểm hình học khác nhau giữa AO lai hóa với AO s và với AO p là gì?
Đặc điểm hình học khác nhau giữa AO lai hóa với AO s và với AO p là gì?


