Câu hỏi:
23/07/2024 104
Quan sát Hình 6.6 và cho biết khi nguyên tử O liên kết với hai nguyên tử H theo cách dùng chung electron thì lớp vỏ của nguyên tử oxygen giống với lớp vỏ của nguyên tử khí hiếm nào?
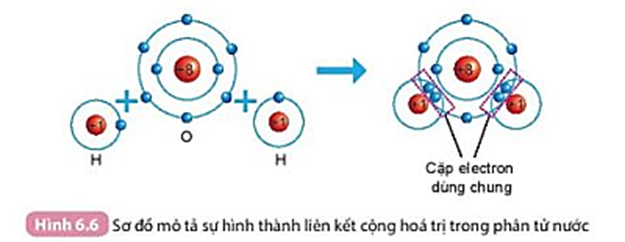
Quan sát Hình 6.6 và cho biết khi nguyên tử O liên kết với hai nguyên tử H theo cách dùng chung electron thì lớp vỏ của nguyên tử oxygen giống với lớp vỏ của nguyên tử khí hiếm nào?

Trả lời:
 Giải bởi Vietjack
Giải bởi Vietjack
Quan sát Hình 6.6, ta thấy nguyên tử O liên kết với hai nguyên tử H theo cách dùng chung electron. Khi này, lớp vỏ của nguyên tử oxygen 10 electron giống với lớp vỏ của nguyên tử khí hiếm Ne.
Quan sát Hình 6.6, ta thấy nguyên tử O liên kết với hai nguyên tử H theo cách dùng chung electron. Khi này, lớp vỏ của nguyên tử oxygen 10 electron giống với lớp vỏ của nguyên tử khí hiếm Ne.
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 1:
Hãy mô tả sự hình thành liên kết cộng hóa trị trong phân tử carbon dioxide, ammonia.
Hãy mô tả sự hình thành liên kết cộng hóa trị trong phân tử carbon dioxide, ammonia.
Câu 2:
Cho sơ đồ mô tả sự hình thành liên kết ion trong phân tử magnesium oxide như sau
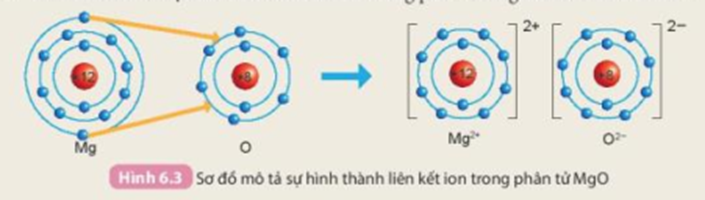
Hãy cho biết nguyên tử Mg đã nhường hay nhận bao nhiêu electron.
Câu 3:
Vận dụng khái niệm liên kết hóa học để giải thích được vì sao trong tự nhiên, muối ăn ở dạng rắn, khó nóng chảy, khó bay hơi, còn đườn ăn, nước đá ở thể rắn dễ nóng chảy và nước ở thể lỏng dễ bay hơi.
Vận dụng khái niệm liên kết hóa học để giải thích được vì sao trong tự nhiên, muối ăn ở dạng rắn, khó nóng chảy, khó bay hơi, còn đườn ăn, nước đá ở thể rắn dễ nóng chảy và nước ở thể lỏng dễ bay hơi.
Câu 4:
Hãy mô tả sự hình thành liên kết cộng hóa trị trong phân tử khí chlorine, khí nitrogen.
Hãy mô tả sự hình thành liên kết cộng hóa trị trong phân tử khí chlorine, khí nitrogen.
Câu 5:
Trong tự nhiên, chỉ có các khí hiếm tồn tại ở dạng đơn nguyên tử bền vững, còn nguyên tử của các nguyên tố khác thường có xu hướng kết hợp với nhau bằng các liên kết hóa học. Các liên kết hóa học được hình thành như thế nào?
Trong tự nhiên, chỉ có các khí hiếm tồn tại ở dạng đơn nguyên tử bền vững, còn nguyên tử của các nguyên tố khác thường có xu hướng kết hợp với nhau bằng các liên kết hóa học. Các liên kết hóa học được hình thành như thế nào?
Câu 6:
Quan sát Hình 6.1, so sánh số electron lớp ngoài cùng của He, Ne và Ar.
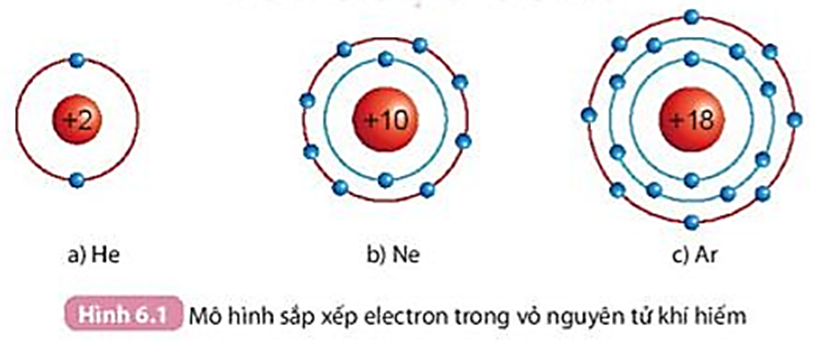
Quan sát Hình 6.1, so sánh số electron lớp ngoài cùng của He, Ne và Ar.

Câu 7:
Quan sát Hình 6.2 và so sánh số electron ở lớp ngoài cùng của nguyên tử Na, Cl với ion Na+, Cl-.
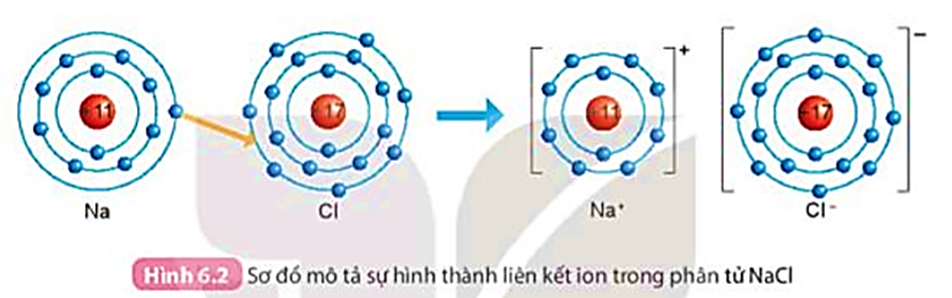
Quan sát Hình 6.2 và so sánh số electron ở lớp ngoài cùng của nguyên tử Na, Cl với ion Na+, Cl-.

Câu 8:
Quan sát Hình 6.4 và Hình 6.5, cho biết số electron lớp ngoài cùng của H và O trước và sau khi tạo thành liên kết cộng hóa trị.
Quan sát Hình 6.4 và Hình 6.5, cho biết số electron lớp ngoài cùng của H và O trước và sau khi tạo thành liên kết cộng hóa trị.