Trả lời:
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án đúng là: A
- Cho phản ứng: 2NH3 + 3Cl2 → N2 + 6HCl. Trong đó, NH3 đóng vai trò .là chất khử
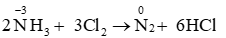
Vậy NH3 đóng vai trò là chất khử.
→ A đúng.B,C,D sai.
* Số oxi hóa
1. Khái niệm số oxi hóa
- Số oxi hóa của một nguyên tử một nguyên tố trong hợp chất là điện tích của nguyên tử nguyên tố đó với giả định đây là hợp chất ion.
Ví dụ:
- Trong các hợp chất ion:
+ K+Cl-: số oxi hóa của K là +1, của Cl là -1.
+ Ca2+O2-: số oxi hóa của Ca là +2, của O là -2.
- Trong các hợp chất cộng hóa trị:
H – O – H: với giả định là hợp chất ion, hai cặp electron dùng chung sẽ lệch hoàn toàn về phía nguyên tử O (có độ âm điện lớn hơn), mỗi liên kết đơn có một electron của H bị chuyển sang O nên hợp chất ion giả định là H+O2-H+. Vậy số oxi hóa của H là +1, của O là -2.
2. Cách xác định số oxi hóa của nguyên tử các nguyên tố trong hợp chất
Có hai cách để xác định số oxi hóa của các nguyên tử nguyên tố hóa học trong hợp chất.
Cách 1: Dựa theo số oxi hóa của một nguyên tử đã biết và điện tích của phân tử hoặc ion. Theo cách này có hai quy tắc:
- Quy tắc 1:
+ Số oxi hóa của nguyên tử nguyên tố trong đơn chất bằng 0.
+ Trong các hợp chất: Số oxi hóa của H là +1 (trừ một số hydride: NaH, CaH2, ...); Số oxi hóa của O là -2 (trừ một số trường hợp như: OF2, H2O2, ...); Số oxi hóa của các kim loại kiềm (nhóm IA: Li, Na, K, ...) luôn là +1; Số oxi hóa của các kim loại kiềm thổ (nhóm IIA: Be, Mg, Ca, Ba, ...) luôn là +2; Số oxi hóa của nhôm luôn là +3.
- Quy tắc 2: Tổng số oxi hóa của các nguyên tử trong phân tử bằng 0, trong một ion đa nguyên tử bằng chính điện tích của ion đó.
Ví dụ 1: Số oxi hóa của các nguyên tố Cu, Fe, O, N trong đơn chất Cu, Fe, O2, N2 đều bằng 0.
Ví dụ 2: Xác định số oxi hóa của N trong HNO3.
Gọi x là số oxi hóa của N, theo quy tắc 1 và 2 có:
1.(+1) + 1.x + 3.(-2) = 0 ⇒ x = +5
Vậy N có số oxi hóa + 5 trong HNO3.
Ví dụ 3: Xác định số oxi hóa của S trong SO2−4
Gọi x là số oxi hóa của S, theo quy tắc 1 và 2 có:
1.x + 4.(-2) = -2 ⇒ x = +6
Vậy S có số oxi hóa + 6 trong SO2−4 .
Cách 2: Dựa theo công thức cấu tạo. Đây là cách tính điện tích các nguyên tử trong hợp chất với giả định đó là hợp chất ion dựa vào công thức cấu tạo.
Ví dụ 3: Xác định số oxi hóa của Si và O trong SiO2.
Silicon dioxide (SiO2) có công thức cấu tạo như sau O = Si = O. Trong mỗi liên kết đôi Si = O, một nguyên tử Si góp 2 electron, khi giả định SiO2 là hợp chất ion thì 2 electron này chuyển sang O. Vì có 2 liên kết Si = O nên SiO2 có công thức ion giả định là O2-Si4+O2-. Từ đó xác định được số oxi hóa của O là – 2, của Si là +4.
Ví dụ 4: Xác định số oxi hóa của H và Cl trong HCl.
Hydrochloric acid (HCl) có công thức cấu tạo như sau H – Cl. Trong liên kết đơn H - Cl, nguyên tử H góp 1 electron, khi giả định HCl là hợp chất ion thì 1 electron này chuyển sang Cl. Do đó HCl có công thức ion giả định là H+Cl-. Từ đó xác định được số oxi hóa của H là + 1, của Cl là -1.
Lưu ý: Cách này có ưu điểm là áp dụng cho mọi trường hợp, tuy nhiên, cần phải biết công thức cấu tạo của chất.
Xem thêm các bài viết liên quan,chi tiết khác:
Đáp án đúng là: A
- Cho phản ứng: 2NH3 + 3Cl2 → N2 + 6HCl. Trong đó, NH3 đóng vai trò .là chất khử
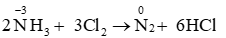
Vậy NH3 đóng vai trò là chất khử.
→ A đúng.B,C,D sai.
* Số oxi hóa
1. Khái niệm số oxi hóa
- Số oxi hóa của một nguyên tử một nguyên tố trong hợp chất là điện tích của nguyên tử nguyên tố đó với giả định đây là hợp chất ion.
Ví dụ:
- Trong các hợp chất ion:
+ K+Cl-: số oxi hóa của K là +1, của Cl là -1.
+ Ca2+O2-: số oxi hóa của Ca là +2, của O là -2.
- Trong các hợp chất cộng hóa trị:
H – O – H: với giả định là hợp chất ion, hai cặp electron dùng chung sẽ lệch hoàn toàn về phía nguyên tử O (có độ âm điện lớn hơn), mỗi liên kết đơn có một electron của H bị chuyển sang O nên hợp chất ion giả định là H+O2-H+. Vậy số oxi hóa của H là +1, của O là -2.
2. Cách xác định số oxi hóa của nguyên tử các nguyên tố trong hợp chất
Có hai cách để xác định số oxi hóa của các nguyên tử nguyên tố hóa học trong hợp chất.
Cách 1: Dựa theo số oxi hóa của một nguyên tử đã biết và điện tích của phân tử hoặc ion. Theo cách này có hai quy tắc:
- Quy tắc 1:
+ Số oxi hóa của nguyên tử nguyên tố trong đơn chất bằng 0.
+ Trong các hợp chất: Số oxi hóa của H là +1 (trừ một số hydride: NaH, CaH2, ...); Số oxi hóa của O là -2 (trừ một số trường hợp như: OF2, H2O2, ...); Số oxi hóa của các kim loại kiềm (nhóm IA: Li, Na, K, ...) luôn là +1; Số oxi hóa của các kim loại kiềm thổ (nhóm IIA: Be, Mg, Ca, Ba, ...) luôn là +2; Số oxi hóa của nhôm luôn là +3.
- Quy tắc 2: Tổng số oxi hóa của các nguyên tử trong phân tử bằng 0, trong một ion đa nguyên tử bằng chính điện tích của ion đó.
Ví dụ 1: Số oxi hóa của các nguyên tố Cu, Fe, O, N trong đơn chất Cu, Fe, O2, N2 đều bằng 0.
Ví dụ 2: Xác định số oxi hóa của N trong HNO3.
Gọi x là số oxi hóa của N, theo quy tắc 1 và 2 có:
1.(+1) + 1.x + 3.(-2) = 0 ⇒ x = +5
Vậy N có số oxi hóa + 5 trong HNO3.
Ví dụ 3: Xác định số oxi hóa của S trong SO2−4
Gọi x là số oxi hóa của S, theo quy tắc 1 và 2 có:
1.x + 4.(-2) = -2 ⇒ x = +6
Vậy S có số oxi hóa + 6 trong SO2−4 .
Cách 2: Dựa theo công thức cấu tạo. Đây là cách tính điện tích các nguyên tử trong hợp chất với giả định đó là hợp chất ion dựa vào công thức cấu tạo.
Ví dụ 3: Xác định số oxi hóa của Si và O trong SiO2.
Silicon dioxide (SiO2) có công thức cấu tạo như sau O = Si = O. Trong mỗi liên kết đôi Si = O, một nguyên tử Si góp 2 electron, khi giả định SiO2 là hợp chất ion thì 2 electron này chuyển sang O. Vì có 2 liên kết Si = O nên SiO2 có công thức ion giả định là O2-Si4+O2-. Từ đó xác định được số oxi hóa của O là – 2, của Si là +4.
Ví dụ 4: Xác định số oxi hóa của H và Cl trong HCl.
Hydrochloric acid (HCl) có công thức cấu tạo như sau H – Cl. Trong liên kết đơn H - Cl, nguyên tử H góp 1 electron, khi giả định HCl là hợp chất ion thì 1 electron này chuyển sang Cl. Do đó HCl có công thức ion giả định là H+Cl-. Từ đó xác định được số oxi hóa của H là + 1, của Cl là -1.
Lưu ý: Cách này có ưu điểm là áp dụng cho mọi trường hợp, tuy nhiên, cần phải biết công thức cấu tạo của chất.
Xem thêm các bài viết liên quan,chi tiết khác:
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 1:
Nhóm nào sau đây gồm các chất vừa có tính oxi hoá, vừa có tính khử?
Câu 2:
Chlorine vừa đóng vai trò chất oxi hóa, vừa đóng vai trò chất khử trong phản ứng nào sau đây?
Chlorine vừa đóng vai trò chất oxi hóa, vừa đóng vai trò chất khử trong phản ứng nào sau đây?
Câu 3:
Cho phản ứng: SO2 + Br2 + H2O → HBr + H2SO4. Trong phản ứng trên, vai trò của Br2
Cho phản ứng: SO2 + Br2 + H2O → HBr + H2SO4. Trong phản ứng trên, vai trò của Br2
Câu 4:
Trong phản ứng: 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Số phân tử nitric acid (HNO3) đóng vai trò chất oxi hóa là
Trong phản ứng: 3Cu + 8HNO3 → 3Cu(NO3)2 + 2NO + 4H2O
Số phân tử nitric acid (HNO3) đóng vai trò chất oxi hóa là
Câu 9:
Phản ứng nào sau đây có sự thay đổi số oxi hóa của nguyên tố calcium?
Phản ứng nào sau đây có sự thay đổi số oxi hóa của nguyên tố calcium?
Câu 10:
Trong phản ứng MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O, vai trò của HCl là
Trong phản ứng MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O, vai trò của HCl là
Câu 12:
Cho phản ứng hóa học: Cl2 + KOH to→ KCl + KClO3 + H2O
Tỉ lệ giữa số nguyên tử chlorine đóng vai trò chất oxi hóa và số nguyên tử chlorine đóng vai trò chất khử trong phương trình hóa học của phản ứng đã cho tương ứng là
Cho phản ứng hóa học: Cl2 + KOH to→ KCl + KClO3 + H2O
Tỉ lệ giữa số nguyên tử chlorine đóng vai trò chất oxi hóa và số nguyên tử chlorine đóng vai trò chất khử trong phương trình hóa học của phản ứng đã cho tương ứng là
Câu 13:
Cho nước Cl2 vào dung dịch KBr xảy ra phản ứng hoá học:
Cl2 + 2KBr → 2KCl + Br2
Trong phản ứng hoá học trên, xảy ra quá trình oxi hoá chất nào?
Cho nước Cl2 vào dung dịch KBr xảy ra phản ứng hoá học:
Cl2 + 2KBr → 2KCl + Br2
Trong phản ứng hoá học trên, xảy ra quá trình oxi hoá chất nào?
Câu 14:
Nguyên tử carbon vừa có khả năng thể hiện tính oxi hoá, vừa có khả năng thể hiện tính khử trong chất nào sau đây?
Nguyên tử carbon vừa có khả năng thể hiện tính oxi hoá, vừa có khả năng thể hiện tính khử trong chất nào sau đây?
Câu 15:
Khi tham gia các phản ứng đốt cháy nhiên liệu, oxygen đóng vai trò là
Khi tham gia các phản ứng đốt cháy nhiên liệu, oxygen đóng vai trò là


