Câu hỏi:
13/07/2024 125
Các nhà hóa học đã nghiên cứu và kết luận rằng nếu không có liên kết hydrogen thì nước sẽ sôi ở -80oC. Như vậy, trong điều kiện thường, nước sẽ tồn tại ở thể khí (hơi nước). Khi đó, trên Trái Đất sẽ chẳng có các đại dương, sông, hồ,… và cũng không bao giờ có mưa. Mọi sự sống sẽ không tồn tại. Trái Đất sẽ là một hành tinh chết nếu không có sự hiện của liên kết hydrogen.
Liên kết hydrogen giữa các phân tử nước được tạo thành như thế nào? Ảnh hưởng của liên kết hydrogen với tính chất vật lí của nước ra sao?

Các nhà hóa học đã nghiên cứu và kết luận rằng nếu không có liên kết hydrogen thì nước sẽ sôi ở -80oC. Như vậy, trong điều kiện thường, nước sẽ tồn tại ở thể khí (hơi nước). Khi đó, trên Trái Đất sẽ chẳng có các đại dương, sông, hồ,… và cũng không bao giờ có mưa. Mọi sự sống sẽ không tồn tại. Trái Đất sẽ là một hành tinh chết nếu không có sự hiện của liên kết hydrogen.
Liên kết hydrogen giữa các phân tử nước được tạo thành như thế nào? Ảnh hưởng của liên kết hydrogen với tính chất vật lí của nước ra sao?

Trả lời:
 Giải bởi Vietjack
Giải bởi Vietjack
Liên kết hydrogen giữa các phân tử nước là một loại liên kết yếu, được hình thành giữa nguyên tử H (đã liên kết với nguyên tử O có độ âm điện lớn) của phân tử nước này với một nguyên tử O (còn cặp electron hóa trị chưa tham gia liên kết) của phân tử nước khác.
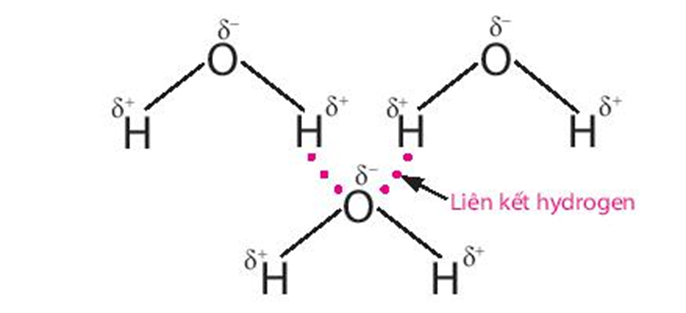
Nhờ có liên kết hydrogen mà ở điều kiện thường nước ở thể lỏng, có nhiệt độ sôi cao (100oC).
Liên kết hydrogen giữa các phân tử nước là một loại liên kết yếu, được hình thành giữa nguyên tử H (đã liên kết với nguyên tử O có độ âm điện lớn) của phân tử nước này với một nguyên tử O (còn cặp electron hóa trị chưa tham gia liên kết) của phân tử nước khác.

Nhờ có liên kết hydrogen mà ở điều kiện thường nước ở thể lỏng, có nhiệt độ sôi cao (100oC).
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 2:
Trong hai chất ammonia (NH3) và phosphine (PH3), theo em chất nào có nhiệt độ sôi và độ tan trong nước lớn hơn? Giải thích
Trong hai chất ammonia (NH3) và phosphine (PH3), theo em chất nào có nhiệt độ sôi và độ tan trong nước lớn hơn? Giải thích
Câu 4:
Giữa liên kết S-H và liên kết O-H, liên kết nào phân cực mạnh hơn? Vì sao?
Giữa liên kết S-H và liên kết O-H, liên kết nào phân cực mạnh hơn? Vì sao?
Câu 5:
So sánh nhiệt độ sôi và khả năng hòa tan trong nước giữa NH3 và CH4. Giải thích
So sánh nhiệt độ sôi và khả năng hòa tan trong nước giữa NH3 và CH4. Giải thích
Câu 6:
Sự phân bố electron không đồng đều trong một nguyên tử hay một phân tử hình thành nên
A. một ion dương
B. một ion âm
C. một lưỡng cực vĩnh viễn
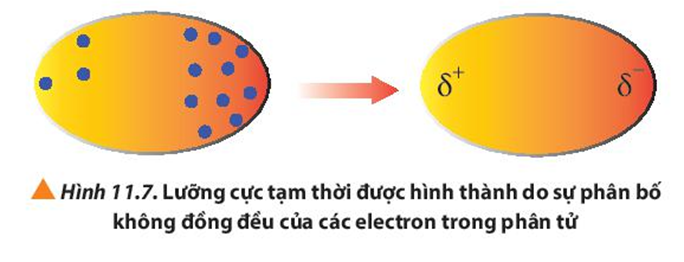
D. một lưỡng cực tạm thời
Sự phân bố electron không đồng đều trong một nguyên tử hay một phân tử hình thành nên
A. một ion dương
B. một ion âm
C. một lưỡng cực vĩnh viễn
D. một lưỡng cực tạm thời
Câu 7:
Quan sát các Hình 11.2 và 11.3, em hiểu thế nào là liên kết hydrogen giữa các phân tử
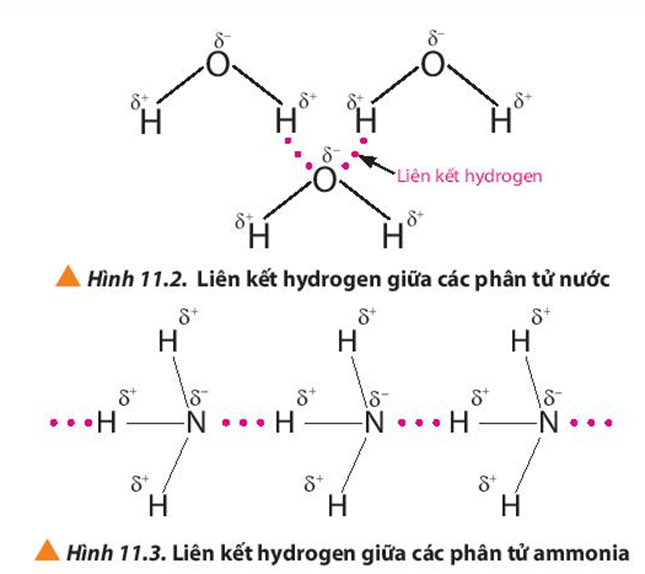
Quan sát các Hình 11.2 và 11.3, em hiểu thế nào là liên kết hydrogen giữa các phân tử

Câu 8:
Vì sao nên tránh ướp lạnh các lon bia, nước giải khát,… trong ngăn đá của tủ lạnh?
Vì sao nên tránh ướp lạnh các lon bia, nước giải khát,… trong ngăn đá của tủ lạnh?
Câu 9:
So sánh độ bền của liên kết hydrogen với liên kết cộng hóa trị và liên kết ion.
So sánh độ bền của liên kết hydrogen với liên kết cộng hóa trị và liên kết ion.
Câu 10:
Khí hiếm nào dưới đây có nhiệt độ sôi thấp nhất?
A. Ne
B. Xe
C. Ar
D. Kr
Khí hiếm nào dưới đây có nhiệt độ sôi thấp nhất?
A. Ne
B. Xe
C. Ar
D. Kr
Câu 11:
Các lưỡng cực tạm thời và lưỡng cực cảm ứng hút nhau bằng lực hút nào?
Các lưỡng cực tạm thời và lưỡng cực cảm ứng hút nhau bằng lực hút nào?
Câu 12:
Biểu diễn liên kết hydrogen giữa các phân tử:
a) Hydrogen fluoride
b) Ethanol (C2H5OH) và nước
Biểu diễn liên kết hydrogen giữa các phân tử:
a) Hydrogen fluoride
b) Ethanol (C2H5OH) và nước
Câu 13:
Hợp chất nào dưới đây tạo được liên kết hydrogen liên phân tử
A. CH4
B. H2O
C. PH3
D. H2S
Hợp chất nào dưới đây tạo được liên kết hydrogen liên phân tử
A. CH4
B. H2O
C. PH3
D. H2S
Câu 15:
Giải thích xu hướng biến đổi bán kính nguyên tử, nhiệt độ nóng chảy và nhiệt độ sôi của các nguyên tố khí hiếm trong Bảng 11.1
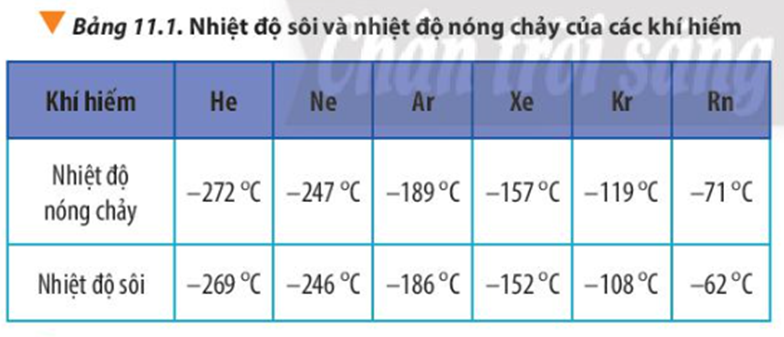
Giải thích xu hướng biến đổi bán kính nguyên tử, nhiệt độ nóng chảy và nhiệt độ sôi của các nguyên tố khí hiếm trong Bảng 11.1