Câu hỏi:
13/07/2024 712
So sánh nhiệt độ sôi và khả năng hòa tan trong nước giữa NH3 và CH4. Giải thích
So sánh nhiệt độ sôi và khả năng hòa tan trong nước giữa NH3 và CH4. Giải thích
Trả lời:
 Giải bởi Vietjack
Giải bởi Vietjack
Công thức Lewis của NH3:
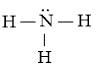
Công thức Lewis của CH4:
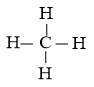
- Nhiệt độ sôi: Nguyên tử N có độ âm điện lớn làm cho liên kết N-H phân cực mạnh, trong phân tử NH3 nguyên tử N còn cặp electron chưa liên kết nên có thể tạo liên kết hydrogen giữa các phân tử NH3 với nhau. Mặt khác, C có độ âm điện nhỏ nên liên kết C-H phân cực yếu, nguyên tử C không còn cặp electron chưa liên kết nên không có khả năng tạo liên kết hydrogen giữa các phân tử CH4 với nhau. Điều này khiến cho nhiệt độ sôi của NH3 cao hơn của CH4.
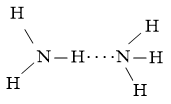
- Khả năng hòa tan trong nước: Giải thích tương tự như nhiệt độ sôi. Phân tử NH3 có thể tạo liên kết hydrogen với nước còn CH4 thì không. Do đó NH3 tan tốt trong nước hơn CH4.
Công thức Lewis của NH3:
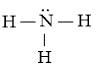
Công thức Lewis của CH4:

- Nhiệt độ sôi: Nguyên tử N có độ âm điện lớn làm cho liên kết N-H phân cực mạnh, trong phân tử NH3 nguyên tử N còn cặp electron chưa liên kết nên có thể tạo liên kết hydrogen giữa các phân tử NH3 với nhau. Mặt khác, C có độ âm điện nhỏ nên liên kết C-H phân cực yếu, nguyên tử C không còn cặp electron chưa liên kết nên không có khả năng tạo liên kết hydrogen giữa các phân tử CH4 với nhau. Điều này khiến cho nhiệt độ sôi của NH3 cao hơn của CH4.

- Khả năng hòa tan trong nước: Giải thích tương tự như nhiệt độ sôi. Phân tử NH3 có thể tạo liên kết hydrogen với nước còn CH4 thì không. Do đó NH3 tan tốt trong nước hơn CH4.

CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 2:
Trong hai chất ammonia (NH3) và phosphine (PH3), theo em chất nào có nhiệt độ sôi và độ tan trong nước lớn hơn? Giải thích
Trong hai chất ammonia (NH3) và phosphine (PH3), theo em chất nào có nhiệt độ sôi và độ tan trong nước lớn hơn? Giải thích
Câu 4:
Giữa liên kết S-H và liên kết O-H, liên kết nào phân cực mạnh hơn? Vì sao?
Giữa liên kết S-H và liên kết O-H, liên kết nào phân cực mạnh hơn? Vì sao?
Câu 5:
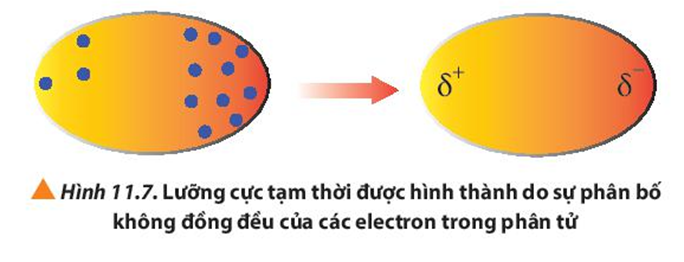
Sự phân bố electron không đồng đều trong một nguyên tử hay một phân tử hình thành nên
A. một ion dương
B. một ion âm
C. một lưỡng cực vĩnh viễn
D. một lưỡng cực tạm thời
Sự phân bố electron không đồng đều trong một nguyên tử hay một phân tử hình thành nên
A. một ion dương
B. một ion âm
C. một lưỡng cực vĩnh viễn
D. một lưỡng cực tạm thời
Câu 6:
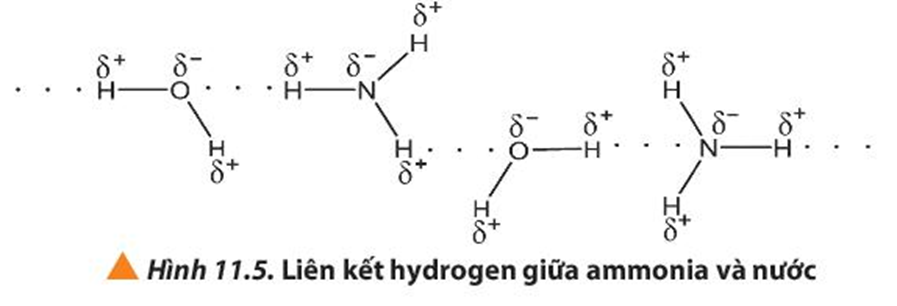
Quan sát các Hình 11.2 và 11.3, em hiểu thế nào là liên kết hydrogen giữa các phân tử
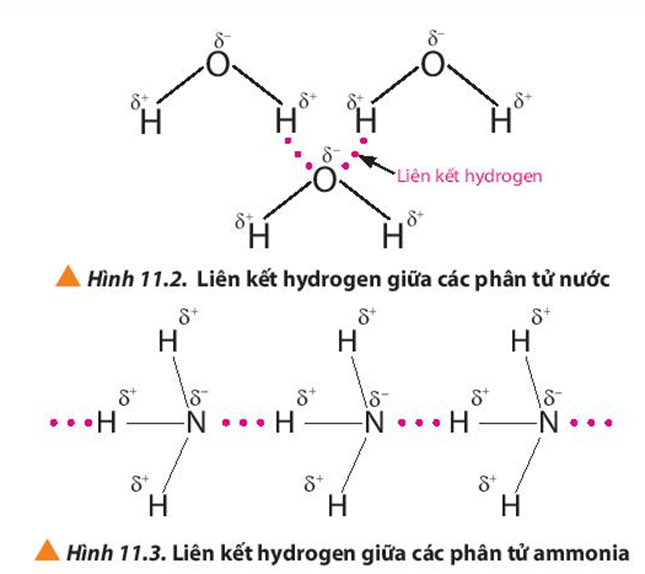
Quan sát các Hình 11.2 và 11.3, em hiểu thế nào là liên kết hydrogen giữa các phân tử

Câu 7:
Vì sao nên tránh ướp lạnh các lon bia, nước giải khát,… trong ngăn đá của tủ lạnh?
Vì sao nên tránh ướp lạnh các lon bia, nước giải khát,… trong ngăn đá của tủ lạnh?
Câu 8:
So sánh độ bền của liên kết hydrogen với liên kết cộng hóa trị và liên kết ion.
So sánh độ bền của liên kết hydrogen với liên kết cộng hóa trị và liên kết ion.
Câu 9:
Khí hiếm nào dưới đây có nhiệt độ sôi thấp nhất?
A. Ne
B. Xe
C. Ar
D. Kr
Khí hiếm nào dưới đây có nhiệt độ sôi thấp nhất?
A. Ne
B. Xe
C. Ar
D. Kr
Câu 10:
Các lưỡng cực tạm thời và lưỡng cực cảm ứng hút nhau bằng lực hút nào?
Các lưỡng cực tạm thời và lưỡng cực cảm ứng hút nhau bằng lực hút nào?
Câu 11:
Biểu diễn liên kết hydrogen giữa các phân tử:
a) Hydrogen fluoride
b) Ethanol (C2H5OH) và nước
Biểu diễn liên kết hydrogen giữa các phân tử:
a) Hydrogen fluoride
b) Ethanol (C2H5OH) và nước
Câu 12:
Hợp chất nào dưới đây tạo được liên kết hydrogen liên phân tử
A. CH4
B. H2O
C. PH3
D. H2S
Hợp chất nào dưới đây tạo được liên kết hydrogen liên phân tử
A. CH4
B. H2O
C. PH3
D. H2S
Câu 14:
Giải thích xu hướng biến đổi bán kính nguyên tử, nhiệt độ nóng chảy và nhiệt độ sôi của các nguyên tố khí hiếm trong Bảng 11.1
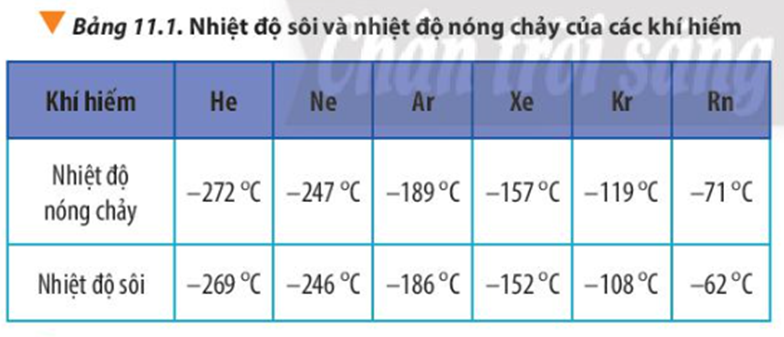
Giải thích xu hướng biến đổi bán kính nguyên tử, nhiệt độ nóng chảy và nhiệt độ sôi của các nguyên tố khí hiếm trong Bảng 11.1

Câu 15:
Giải thích vì sao một phân tử nước có thể tạo được liên kết hydrogen tối đa với bốn phân tử nước khác
Giải thích vì sao một phân tử nước có thể tạo được liên kết hydrogen tối đa với bốn phân tử nước khác