Câu hỏi:
21/07/2024 148
c) Sulfur dioxide làm mất màu dung dịch thuốc tím:
SO2 + KMnO4 + H2O ⟶ MnSO4 + K2SO4 + H2SO4
c) Sulfur dioxide làm mất màu dung dịch thuốc tím:
SO2 + KMnO4 + H2O ⟶ MnSO4 + K2SO4 + H2SO4
Trả lời:
 Giải bởi Vietjack
Giải bởi Vietjack
c)
Ta có:
Vậy 5SO2 + 2KMnO4 + 2H2O ⟶ 2MnSO4 + K2SO4 + 2H2SO4
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 1:
d) Để xác định công thức của oleum thu được, người ta pha loãng 8,36 gam oleum vào nước thành 1,0 lít dung dịch sulfuric acid, sau đó tiến hành chuẩn độ mỗi 10,0 mL dung dịch acid này bằng dung dịch NaOH 0,10 M. Thể tích NaOH trung bình cần sử dụng để chuẩn độ là 20,01 mL. Hãy xác định công thức của oleum trên.
d) Để xác định công thức của oleum thu được, người ta pha loãng 8,36 gam oleum vào nước thành 1,0 lít dung dịch sulfuric acid, sau đó tiến hành chuẩn độ mỗi 10,0 mL dung dịch acid này bằng dung dịch NaOH 0,10 M. Thể tích NaOH trung bình cần sử dụng để chuẩn độ là 20,01 mL. Hãy xác định công thức của oleum trên.
Câu 2:
Những đặc điểm nào sau đây về muối sulfate là đúng?
(a) Nhiều muối sulfate tan tốt trong nước nhưng một số muối như CaSO4, BaSO4 rất ít tan trong nước.
(b) Magnesium sulfate được dùng làm thuốc điều trị bệnh liên quan đến hồng cầu, dùng làm chất hút mồ hôi tay cho các vận động viên,…
(c) Calcium sulfate là thành phần chính của các loại thạch cao. Phân tử chất này thường ngậm nước với số lượng các phân tử H2O khác nhau, tạo ra các loại thạch cao có ứng dụng khác nhau.
(d) Barium sulfate là chất rắn màu trắng, hầu như không tan trong nước. Chất này được dùng tạo màu trắng cho các loại giấy chất lượng cao.
Những đặc điểm nào sau đây về muối sulfate là đúng?
(a) Nhiều muối sulfate tan tốt trong nước nhưng một số muối như CaSO4, BaSO4 rất ít tan trong nước.
(b) Magnesium sulfate được dùng làm thuốc điều trị bệnh liên quan đến hồng cầu, dùng làm chất hút mồ hôi tay cho các vận động viên,…
(c) Calcium sulfate là thành phần chính của các loại thạch cao. Phân tử chất này thường ngậm nước với số lượng các phân tử H2O khác nhau, tạo ra các loại thạch cao có ứng dụng khác nhau.
(d) Barium sulfate là chất rắn màu trắng, hầu như không tan trong nước. Chất này được dùng tạo màu trắng cho các loại giấy chất lượng cao.
Câu 3:
b) Theo nguyên lí chuyển dịch cân bằng, phản ứng (2) nên được thực hiện ở nhiệt độ cao hay thấp? Trong thực tế, phản ứng trên được thực hiện ở nhiệt độ khá cao (450oC), hãy giải thích điều này.
b) Theo nguyên lí chuyển dịch cân bằng, phản ứng (2) nên được thực hiện ở nhiệt độ cao hay thấp? Trong thực tế, phản ứng trên được thực hiện ở nhiệt độ khá cao (450oC), hãy giải thích điều này.
Câu 4:
d) Sulfuric acid oxi hoá hợp chất Fe(II) thành hợp chất Fe(III):
H2SO4 + FeSO4 → Fe2(SO4)3 + SO2 + H2O
d) Sulfuric acid oxi hoá hợp chất Fe(II) thành hợp chất Fe(III):
H2SO4 + FeSO4 → Fe2(SO4)3 + SO2 + H2O
Câu 5:
c) Người ta dùng sulfuric acid đặc H2SO4(aq) hấp thụ SO3(g) trong phản ứng (3), quá trình này được thực hiện trong tháp tiếp xúc. Cách thực hiện nào sau đây sẽ đạt hiệu quả tiếp xúc tốt nhất?
A. Cho SO3(g) lội qua dung dịch H2SO4(aq).
B. SO3(g) được phun vào từ phía trên tháp, H2SO4(aq) được bơm từ dưới lên.
C. SO3(g) được xả vào từ phía dưới tháp, H2SO4(aq) được phun từ trên xuống.
D. SO3(g) lội qua H2SO4(aq) được khuấy liên tục với tốc độ cao.
c) Người ta dùng sulfuric acid đặc H2SO4(aq) hấp thụ SO3(g) trong phản ứng (3), quá trình này được thực hiện trong tháp tiếp xúc. Cách thực hiện nào sau đây sẽ đạt hiệu quả tiếp xúc tốt nhất?
A. Cho SO3(g) lội qua dung dịch H2SO4(aq).
B. SO3(g) được phun vào từ phía trên tháp, H2SO4(aq) được bơm từ dưới lên.
C. SO3(g) được xả vào từ phía dưới tháp, H2SO4(aq) được phun từ trên xuống.
D. SO3(g) lội qua H2SO4(aq) được khuấy liên tục với tốc độ cao.
Câu 6:
c) Có thể pha chế dung dịch copper(II) sulfate 10–4 M dùng để diệt một số loại vi sinh vật. Tính số mg copper(II) sulfate pentahydrate cần dùng để pha chế thành 1 L dung dịch copper(II) sulfate 10–4 M.
c) Có thể pha chế dung dịch copper(II) sulfate 10–4 M dùng để diệt một số loại vi sinh vật. Tính số mg copper(II) sulfate pentahydrate cần dùng để pha chế thành 1 L dung dịch copper(II) sulfate 10–4 M.
Câu 8:
Trong công nghiệp, chất rắn copper(II) sulfate pentahydrate có thể được sản xuất từ copper(II) oxide theo hai giai đoạn của quá trình:
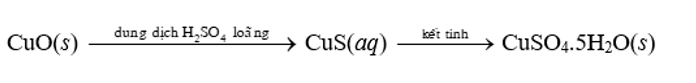
a) Từ 1 tấn nguyên liệu chứa 96% copper(II) oxide theo khối lượng (còn lại là tạp chất trơ) sẽ thu được bao nhiêu kilôgam copper(II) sulfate pentahydrate rắn? Cho hiệu suất của quá trình là 85%.
Trong công nghiệp, chất rắn copper(II) sulfate pentahydrate có thể được sản xuất từ copper(II) oxide theo hai giai đoạn của quá trình:
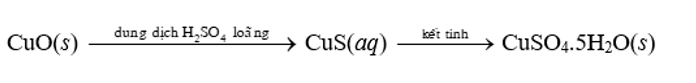
a) Từ 1 tấn nguyên liệu chứa 96% copper(II) oxide theo khối lượng (còn lại là tạp chất trơ) sẽ thu được bao nhiêu kilôgam copper(II) sulfate pentahydrate rắn? Cho hiệu suất của quá trình là 85%.
Câu 9:
b) Sulfur dioxide làm mất màu dung dịch bromine:
SO2 + Br2 + H2O → HBr + H2SO4
b) Sulfur dioxide làm mất màu dung dịch bromine:
SO2 + Br2 + H2O → HBr + H2SO4
Câu 10:
Dưới đây là một số phản ứng minh hoạ tính oxi hoá của sulfuric acid và sulfur dioxide. Đa số các phản ứng này có ứng dụng trong phòng thí nghiệm, Hãy cân bằng phương trình hoá học các phản ứng bằng phương pháp thăng bằng electron.
a) Sulfuric acid đặc phản ứng với carbon trong than:
H2SO4(đặc) + C ⟶ CO2 + SO2 + H2O
Dưới đây là một số phản ứng minh hoạ tính oxi hoá của sulfuric acid và sulfur dioxide. Đa số các phản ứng này có ứng dụng trong phòng thí nghiệm, Hãy cân bằng phương trình hoá học các phản ứng bằng phương pháp thăng bằng electron.
a) Sulfuric acid đặc phản ứng với carbon trong than:
H2SO4(đặc) + C ⟶ CO2 + SO2 + H2O
Câu 11:
Nhiều hộ gia đình thường trữ một số hoá chất như baking soda (NaHCO3), thạch cao nung (CaSO4.0,5H2O) và phèn chua (hay phèn nhôm kali, K2SO4.Al2(SO4)3.24H2O hay KAl(SO4)2.12H2O).
a) Hãy tìm hiểu các ứng dụng của mỗi hoá chất trên tại các hộ gia đình.
Nhiều hộ gia đình thường trữ một số hoá chất như baking soda (NaHCO3), thạch cao nung (CaSO4.0,5H2O) và phèn chua (hay phèn nhôm kali, K2SO4.Al2(SO4)3.24H2O hay KAl(SO4)2.12H2O).
a) Hãy tìm hiểu các ứng dụng của mỗi hoá chất trên tại các hộ gia đình.
Câu 12:
Hãy mô tả hiện tượng xảy ra và hoàn thành phương trình hoá học của phản ứng xảy ra khi sulfuric acid loãng:
a) Tiếp xúc với lá kim loại hoạt động bị phủ bởi lớp oxide kim loại (chẳng hạn, lá kẽm (zinc) bị phủ bởi lớp zinc oxide).
Hãy mô tả hiện tượng xảy ra và hoàn thành phương trình hoá học của phản ứng xảy ra khi sulfuric acid loãng:
a) Tiếp xúc với lá kim loại hoạt động bị phủ bởi lớp oxide kim loại (chẳng hạn, lá kẽm (zinc) bị phủ bởi lớp zinc oxide).
Câu 13:
Câu 15:
c) Hydrogen iodide có tính khử khá mạnh. Hãy dự đoán khí này có phản ứng với sulfuric acid đặc không. Giải thích.
c) Hydrogen iodide có tính khử khá mạnh. Hãy dự đoán khí này có phản ứng với sulfuric acid đặc không. Giải thích.


