Câu hỏi:
22/07/2024 842
b) Nếu cho 2 mol H2 và 2 mol I2 vào bình kín dung tích 10 lít, giữ bình ở 430oC thì nồng độ các chất ở trạng thái cân bằng là bao nhiêu?
b) Nếu cho 2 mol H2 và 2 mol I2 vào bình kín dung tích 10 lít, giữ bình ở 430oC thì nồng độ các chất ở trạng thái cân bằng là bao nhiêu?
Trả lời:
 Giải bởi Vietjack
Giải bởi Vietjack
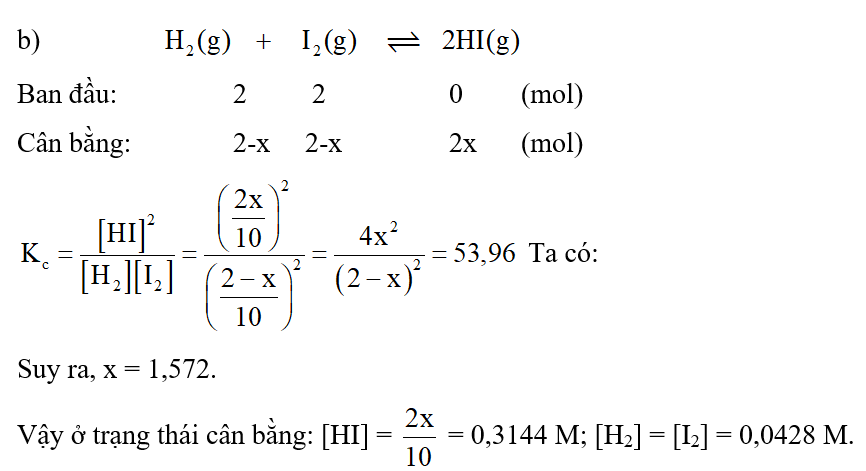
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 1:
c) Cho 10 mL dung dịch NaOH 0,1 M vào 10 mL dung dịch CH3COOH 0,2 M thu được 20 mL dung dịch A. Tính pH của dung dịch A.
c) Cho 10 mL dung dịch NaOH 0,1 M vào 10 mL dung dịch CH3COOH 0,2 M thu được 20 mL dung dịch A. Tính pH của dung dịch A.
Câu 2:
Ethanol và propanoic acid phản ứng với nhau tạo thành ethyl propanoate theo phản ứng hoá học sau:
Ở 50oC, giá trị Kc của phản ứng trên là 7,5. Nếu cho 23,0 gam ethanol phản ứng với 37,0 g propanoic acid ở 50OC thì khối lượng của ethyl propanoate thu được trong hỗn hợp ở trạng thái cân bằng là bao nhiêu? (Coi tồng thể tích của hệ phản ứng không đổi).
Ethanol và propanoic acid phản ứng với nhau tạo thành ethyl propanoate theo phản ứng hoá học sau:
Ở 50oC, giá trị Kc của phản ứng trên là 7,5. Nếu cho 23,0 gam ethanol phản ứng với 37,0 g propanoic acid ở 50OC thì khối lượng của ethyl propanoate thu được trong hỗn hợp ở trạng thái cân bằng là bao nhiêu? (Coi tồng thể tích của hệ phản ứng không đổi).
Câu 3:
b) Lấy 5,0 mL dung dịch A rồi chuẩn độ với dung dịch HCl 0,1 M thì thấy hết 5,2 mL. Tính nồng độ dung dịch A từ kết quả chuẩn độ trên.
b) Lấy 5,0 mL dung dịch A rồi chuẩn độ với dung dịch HCl 0,1 M thì thấy hết 5,2 mL. Tính nồng độ dung dịch A từ kết quả chuẩn độ trên.
Câu 4:
c) Nêu một số nguyên nhân dẫn đến việc sai khác nồng độ dung dịch A trong câu a và b.
c) Nêu một số nguyên nhân dẫn đến việc sai khác nồng độ dung dịch A trong câu a và b.
Câu 5:
Một học sinh cân 1,062 g NaOH rắn rồi pha thành 250 mL dung dịch A.
a) Tính nồng độ CM của dung dịch A.
Một học sinh cân 1,062 g NaOH rắn rồi pha thành 250 mL dung dịch A.
a) Tính nồng độ CM của dung dịch A.
Câu 6:
Ascobic acid (vitamin C) là một acid hũu cơ được kí hiệu đơn giản là HAsc, phân tử khối là 176. Một học sinh hoà tan 5,0 g ascorbic acid vào 250 ml nước. Tính pH của dung dịch thu được, biết trong dung dịch có cân bằng sau:
Ascobic acid (vitamin C) là một acid hũu cơ được kí hiệu đơn giản là HAsc, phân tử khối là 176. Một học sinh hoà tan 5,0 g ascorbic acid vào 250 ml nước. Tính pH của dung dịch thu được, biết trong dung dịch có cân bằng sau:
Câu 7:
Cho các dung dịch sau: HCl 0,1 M, H2SO4 0,1 M và CH3COOH 0,1 M. Sắp xếp các dung dịch trên theo chiều giá trị pH giảm dần. Giải thích.
Cho các dung dịch sau: HCl 0,1 M, H2SO4 0,1 M và CH3COOH 0,1 M. Sắp xếp các dung dịch trên theo chiều giá trị pH giảm dần. Giải thích.
Câu 8:
Dung dịch HCl có pH = 1 (dung dịch A), dung dịch NaOH có pH = 13 (dung dịch B). Tính pH của dung dịch sau khi trộn:
a) 5 mL dung dịch A và 10 mL dung dịch B.
Dung dịch HCl có pH = 1 (dung dịch A), dung dịch NaOH có pH = 13 (dung dịch B). Tính pH của dung dịch sau khi trộn:
a) 5 mL dung dịch A và 10 mL dung dịch B.
Câu 9:
Trong dung dịch nước, cation kim loại mạnh, gốc acid mạnh không bị thuỷ phân, còn cation kim loại trung bình và yếu bị thuỷ phân tạo môi trường acid, gốc acid yếu bị thuỷ phân tạo môi trường base. Dung dịch muối nào sau đây có pH < 7 ?
A. FeCl3.
B. KCl.
C. Na2CO3.
D. Na2SO4.
Trong dung dịch nước, cation kim loại mạnh, gốc acid mạnh không bị thuỷ phân, còn cation kim loại trung bình và yếu bị thuỷ phân tạo môi trường acid, gốc acid yếu bị thuỷ phân tạo môi trường base. Dung dịch muối nào sau đây có pH < 7 ?
A. FeCl3.
B. KCl.
C. Na2CO3.
D. Na2SO4.
Câu 10:
Cho cân bằng hoá học sau:
Cho 3,0 mol khí hydrogen và 1,0 mol khí nitrogen vào một bình kín dung tích 10 lít, có bột iron xúc tác, giữ bình ở 450oC. Ở trạng thái cân bằng có 20% chất đầu chuyền hoá thành sản phẩm.
a) Xác định số mol các chất ở trạng thái cân bằng.
Cho cân bằng hoá học sau:
Cho 3,0 mol khí hydrogen và 1,0 mol khí nitrogen vào một bình kín dung tích 10 lít, có bột iron xúc tác, giữ bình ở 450oC. Ở trạng thái cân bằng có 20% chất đầu chuyền hoá thành sản phẩm.
a) Xác định số mol các chất ở trạng thái cân bằng.
Câu 12:
Cho phản ứng hoá học sau:
Nhận xét nào sau đây không đúng?
A. Nếu tăng nhiệt độ thì cân bằng trên chuyển dịch theo chiều nghịch.
B. Nếu tăng áp suất thì cân bằng trên chuyển dịch theo chiều nghịch.
C. Hằng số cân bằng của phản ứng trên chỉ phụ thuộc vào nhiệt độ.
D. Phản ứng thuận là phản ứng toả nhiệt.
Cho phản ứng hoá học sau:
Nhận xét nào sau đây không đúng?
A. Nếu tăng nhiệt độ thì cân bằng trên chuyển dịch theo chiều nghịch.
B. Nếu tăng áp suất thì cân bằng trên chuyển dịch theo chiều nghịch.
C. Hằng số cân bằng của phản ứng trên chỉ phụ thuộc vào nhiệt độ.
D. Phản ứng thuận là phản ứng toả nhiệt.
Câu 13:
Cho phản ứng thuận nghịch sau:
Ở 430oC, nồng độ các chất ở trạng thái cân bằng là: [H2] = [I2] = 0,107 mol/L; [HI] = 0,786 mol/L.
a) Tính hằng số cân bằng (Kc) của phản ứng ở 430oC.
Cho phản ứng thuận nghịch sau:
Ở 430oC, nồng độ các chất ở trạng thái cân bằng là: [H2] = [I2] = 0,107 mol/L; [HI] = 0,786 mol/L.
a) Tính hằng số cân bằng (Kc) của phản ứng ở 430oC.
Câu 14:
Methylamine (CH3NH2) là chất có mùi tanh, được sử dụng làm dược phẩm, thuốc trừ sâu,... Trong dung dịch nước methylamin nhận proton của nước. Viết phương trình hoá học của phản ứng giữa methylamine và nước, xác định đâu là acid, base trong phản ứng. Dự đoán môi trường của dung dịch CH3NH2.
Methylamine (CH3NH2) là chất có mùi tanh, được sử dụng làm dược phẩm, thuốc trừ sâu,... Trong dung dịch nước methylamin nhận proton của nước. Viết phương trình hoá học của phản ứng giữa methylamine và nước, xác định đâu là acid, base trong phản ứng. Dự đoán môi trường của dung dịch CH3NH2.
Câu 15:
b) Trong dung dịch nước ion CH3COO- nhận proton của nước. Viết phương trình thuỷ phân và cho biết môi trường của dung dịch CH3COONa.
b) Trong dung dịch nước ion CH3COO- nhận proton của nước. Viết phương trình thuỷ phân và cho biết môi trường của dung dịch CH3COONa.


