Trắc nghiệm Luyện tập tính chất hóa học của oxit và axit (có đáp án)
Trắc nghiệm Hóa học 9 Bài 5: Luyện tập tính chất hóa học của oxit và axit
-
194 lượt thi
-
15 câu hỏi
-
30 phút
Danh sách câu hỏi
Câu 1:
11/07/2024Chất nào dưới đây không tác dụng với dung dịch axit HCl là
 Xem đáp án
Xem đáp án
Đáp án D
Chất không tác dụng với dung dịch axit HCl là Ag, vì Ag là kim loại đứng sau hidro trong dãy hoạt động hóa học của kim loại.
Câu 2:
22/07/2024Cho những oxit sau: CuO, CO2, K2O, CaO. Hãy cho biết có bao nhiêu oxit tác dụng được với nước?
 Xem đáp án
Xem đáp án
Đáp án C
Oxit tác dụng được với nước là:
CO2, K2O, CaO
Phương trình phản ứng là:
CO2 + H2O → H2CO3
K2O + H2O → 2KOH
CaO + H2O → Ca(OH)2
Câu 3:
23/07/2024Cho 4,48 lít khí CO2 (đktc) tác dụng vừa hết với 200ml dung dịch Ba(OH)2, thu được sản phẩm là BaCO3 và H2O. Nồng độ mol của dung dịch Ba(OH)2 đã dùng là
 Xem đáp án
Xem đáp án
Đáp án B
Số mol của khí CO2 là:
nCO2=4,4822,4 = 0,2 mol
Phương trình phản ứng:
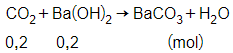
Theo phương trình phản ứng, ta có:
nBa(OH)2 = 0,2 mol
Vậy nồng độ mol của dung dịch Ba(OH)2 là:
CM = nV=0,20,2 = 1M
Câu 4:
22/07/2024Chất tác dụng với nước tạo ra dung dịch axit là
 Xem đáp án
Xem đáp án
Đáp án D
Phương trình phản ứng:
P2O5 + 3H2O → 2H3PO4
Câu 5:
23/07/2024Để phân biệt 3 ống nghiệm chứa dung dịch HCl, dung dịch H2SO4 và nước người ta dùng
 Xem đáp án
Xem đáp án
Đáp án C
- Cho 3 mẩu quỳ tím vào 3 ống nghiệm, nếu:
+ Quỳ tím không đổi màu → dung dịch trong ống nghiệm là nước.
+ Quỳ tím chuyển sang màu đỏ → dung dịch trong ống nghiệm là HCl hoặc H2SO4
- Sử dụng BaCl2 để phân biệt HCl và H2SO4, nếu:
+ Xuất hiện kết tủa thì đó là ống nghiệm đựng H2SO4 (kết tủa BaSO4)
Phương trình phản ứng:
BaCl2 + H2SO4 → BaSO4 ↓ + 2HCl
+ Không có hiện tượng gì xuất hiện → dung dịch trong ống nghiệm là HCl.
Câu 6:
21/07/2024Hoà tan 9,3 gam natri oxit vào nước thu được 60 gam dung dịch X. Nồng độ phần trăm của dung dịch X là:
 Xem đáp án
Xem đáp án
Đáp án A
Số mol của Na2O là:
nNa2O=9,362 = 0,15 mol
Phương trình phản ứng:
Na2O+H2O→2NaOH0,15 0,3(mol)
Theo phương trình phản ứng ta có:
nNaOH = 0,3 mol
Khối lượng của NaOH là:
mNaOH = 0,3.40 = 12 gam
Nồng độ phần trăm của dung dịch X là:
C%=mNaOHmdd.100%=1260.100%=20%
Câu 7:
20/07/2024Khí CO bị lẫn tạp chất là khí CO2. Để thu được CO tinh khiết cần?
 Xem đáp án
Xem đáp án
Đáp án C
Dẫn hỗn hợp khí qua lượng dư dung dịch Ca(OH)2. Khí CO2 phản ứng, bị giữ lại, khí CO không phản ứng thoát ra khỏi dung dịch, thu được CO tinh khiết.
Phương trình hóa học:
CO2 + Ca(OH)2 → CaCO3↓ + H2O
Câu 8:
21/07/2024Nhỏ từ từ dung dịch axit clohiđric vào cốc đựng một mẩu đá vôi cho đến dư axit. Hiện tượng nào sau đây xảy ra?
 Xem đáp án
Xem đáp án
Đáp án A
Nhỏ từ từ dung dịch axit clohiđric vào cốc đựng một mẩu đá vôi cho đến dư axit. Hiện tượng xảy ra: Sủi bọt khí (khí CO2), đá vôi tan dần
Phương trình phản ứng:
CaCO3 + 2HCl → CaCl2 + CO2↑ + H2O
Câu 9:
22/07/2024Khối lượng dung dịch KOH 32% cần dùng để trung hòa 200 ml dung dịch HCl 2M là
 Xem đáp án
Xem đáp án
Đáp án D
Số mol của HCl là:
nHCl = 0,2.2 = 0,4 mol
Phương trình phản ứng:
KOH+HCl→KCl+H2O0,4 0,4 (mol)
Theo phương trình phản ứng ta có:
nKOH = 0,4 mol
Khối lượng KOH là:
mKOH = 0,4.56 = 22,4 gam
Khối lượng dung dịch KOH 32% cần dùng là:
mdd=mKOH.100%C%=22,4.100%32%=70 gam
Câu 10:
15/07/2024Cho nhôm tác dụng với dung dịch axit sunfuric loãng, xảy ra theo phương trình phản ứng:
Al + H2SO4 → Al2(SO4)3 + H2
Tổng hệ số cân bằng (là các số nguyên, tối giản) trong phương trình hoá học là
 Xem đáp án
Xem đáp án
Đáp án C
Phương trình phản ứng:
2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Tổng hệ số cân bằng (là các số nguyên, tối giản) trong phương trình hóa học là:
2 + 3 + 1 + 3 = 9
Câu 11:
23/07/2024Cho 13,44 lít khí CO2 ở đktc tác dụng với lượng dư dung dịch Ba(OH)2, sau phản ứng thu được m gam kết tủa. Giá trị của m là
 Xem đáp án
Xem đáp án
Đáp án B
Số mol của khí CO2 là:
nCO2=13,4422,4= 0,6 mol
Phương trình phản ứng:
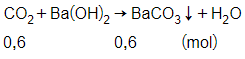
Theo phương trình phản ứng, ta có
nBaCO3= 0,6 mol
Vậy khối lượng BaCO3 là:
m = 0,6.197 = 118,2 gam.
Câu 12:
19/07/2024Kim loại X tác dụng với HCl sinh ra khí hiđro. Dẫn khí hiđro qua oxit của kim loại Y đun nóng thì thu được kim loại Y. Hai kim loại X và Y lần lượt là:
 Xem đáp án
Xem đáp án
Đáp án B
X tác dụng với HCl
→ X không thể là Cu và Ag
→ loại A và D.
Oxit của Y tác dụng được với H2
→ Y không thể là Ca
→ loại C.
Câu 13:
23/07/2024Hòa tan hết hỗn hợp gồm CaO và CaCO3 cần vừa đủ 100 ml dung dịch HCl 3M. Khối lượng muối có trong dung dịch thu được là
 Xem đáp án
Xem đáp án
Đáp án : A
Số mol HCl
nHCl= 0,1.3 = 0,3 mol
Gọi số mol CaO là x mol; số mol CaCO3 là y mol
Ta có phương trình hóa học:
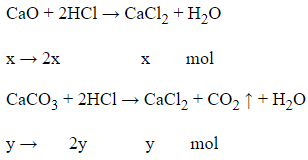
Theo PTHH có:
nHCl = 2x + 2y = 0,3 mol
→ x + y = 0,15 mol
Muối thu được là CaCl2: (x + y) mol
→ mmuối = (x + y).(40 + 71)
→ mmuối = 0,15.111=16,65 gam.
Câu 14:
22/07/2024Cho cùng một lượng sắt và kẽm tác dụng hết với lượng dư axit clohidric thì
 Xem đáp án
Xem đáp án
Đáp án C
Giả sử: mFe = mZn = m gam.
Fe+2HCl→FeCl2+H2m56 m56 molZn+2HCl→ZnCl2+H2m65 m65 mol
Có m56>m65 nên cho cùng một lượng sắt và kẽm tác dụng hết với lượng dư axit clohidric thì lượng H2 thoát ra từ sắt nhiều hơn kẽm
Câu 15:
21/07/2024Cho 6 gam kim loại Mg tan hoàn toàn trong dung dịch H2SO4 loãng, dư. Sau phản ứng thu được V lít khí thoát ra ở đktc. Giá trị của V là
 Xem đáp án
Xem đáp án
Đáp án C
Số mol của Mg là:
nMg = 0,25 mol
Phương trình phản ứng:
Mg+H2SO4→MgSO4+H20,25 0,25 mol
Theo phương trình phản ứng ta có:
nH2 = 0,25 mol
Thể tích khí H2 là:
V = 0,25.22,4 = 5,6 lít.
