Giải SGK Hóa 11 Cánh diều Bài 3: pH của dung dịch. Chuẩn độ acid – base
Giải SGK Hóa 11 Cánh diều Bài 3: pH của dung dịch. Chuẩn độ acid – base
-
334 lượt thi
-
17 câu hỏi
-
0 phút
Danh sách câu hỏi
Câu 1:
23/07/2024Các acid như acetic acid trong giấm ăn, citric acid trong quả chanh, oxalic acid trong quả khế đều tan và phân li trong nước. Chẳng hạn, acetic acid (CH3COOH) phân li theo phương trình sau:
CH3COOH ⇌ CH3COO- + H+
a) Em hãy dự đoán vị chua của các acid trên được gây ra bởi ion nào.
b) Trong chế biến nước chấm, càng cho nhiều giấm ăn thì nước chấm càng chua. Khi đó nồng độ của ion nào tăng lên?
c) Làm thế nào để xác định được nồng độ ion H+ trong dung dịch acid?
 Xem đáp án
Xem đáp án
a) Vị chua của các acid được gây ra bởi ion H+.
b) Trong chế biến nước chấm, càng cho nhiều giấm ăn thì nước chấm càng chua. Khi đó nồng độ của ion H+ tăng lên.
c) Để xác định được nồng độ ion H+ trong dung dịch acid người ta có thể dùng phương pháp chuẩn độ.
Câu 2:
17/07/2024Giải thích vì sao nước nguyên chất có môi trường trung tính.
 Xem đáp án
Xem đáp án
Nước điện li tạo ra đồng thời cả H+ và OH-:
H2O ⇌ H+ + OH-
Tuy nhiên sự điện li này rất yếu. Ở 25 oC, nồng độ ion H+ và OH- trong nước là vô cùng nhỏ: [H+] = [OH-] = 10-7 M. Vì vậy nước nguyên chất có môi trường trung tính.
Câu 3:
13/07/2024Giải thích vì sao khi thêm HCl vào nước nguyên chất thì dung dịch thu được có [H+] > 10-7 M.
 Xem đáp án
Xem đáp án
Nước điện li tạo ra đồng thời cả H+ và OH-:
H2O ⇌ H+ + OH-
Ở 25 oC, nồng độ ion H+ và OH- trong nước là vô cùng nhỏ: [H+] = [OH-] = 10-7 M.
Khi thêm HCl vào nước nguyên chất thì có thêm một lượng H+ từ acid (HCl → H+ + Cl-) nên trong dung dịch có [H+] > [OH-], do đó [H+] > 10-7.
Câu 4:
22/07/2024Sử dụng máy tính cầm tay để tính:
a) pH của các dung dịch có nồng độ H+ lần lượt là: 0,01 M; 0,5 M và 1 M.
b) Nồng độ H+ của các dung dịch có pH lần lượt là 2,0; 7,4 và 14.
 Xem đáp án
Xem đáp án
a) Áp dụng công thức pH = -log[H+] ta có pH của các dung dịch được thể hiện trong bảng sau:
|
Nồng độ (M) |
0,01 |
0,5 |
1 |
|
pH |
2 |
0,3 |
0 |
b) Áp dụng công thức [H+] = 10-pH ta có nồng độ H+ của các dung dịch được thể hiện trong bảng sau:
|
pH |
2 |
7,4 |
14 |
|
Nồng độ (M) |
0,01 |
3,98.10-8 |
10-14 |
Câu 5:
21/07/2024Giải thích vì sao việc thiếu acid trong dạ dày là một nguyên nhân gây nên bệnh nhiễm khuẩn đường tiêu hoá.
 Xem đáp án
Xem đáp án
Dịch vị dạ dày của con người chứa acid HCl với pH dao động khoảng 1,5 đến 3,5. Đây là khoảng pH phù hợp để enzyme tiêu hoá hoạt động hiệu quả. Ngoài ra, HCl còn làm nhiệm vụ sát khuẩn, tiêu diệt nhiều loại vi khuẩn có trong thức ăn. Do đó việc thiếu acid trong dạ dày là nguyên nhân gây nên bệnh nhiễm khuẩn đường tiêu hoá.
Câu 6:
14/07/2024Vì sao có thể dùng thuốc muối NaHCO3 khi điều trị bệnh thừa acid trong dạ dày?
 Xem đáp án
Xem đáp án
Dịch vị dạ dày của con người có chứa acid HCl với pH dao động khoảng 1,5 đến 3,5. Khi nồng độ acid trong dạ dày tăng cao con người sẽ bị đau dạ dày. Thuốc muối chứa NaHCO3 sẽ phản ứng với HCl giúp làm giảm nồng độ HCl trong dạ dày, làm giảm cơn đau dạ dày.
NaHCO3 + HCl → NaCl + CO2 + H2O.
Câu 7:
17/07/2024Đất nhiễm phèn có pH trong khoảng 4,5 – 5,0. Hãy giải thích vì sao người ta thường bón vôi bột (CaO) để cải tạo loại đất này.
 Xem đáp án
Xem đáp án
Phạm vi pH tối ưu cho hầu hết các cây trồng là từ 5,5 đến 7,5. Đất nhiễm phèn có pH trong khoảng 4,5 – 5,0 (hay có nồng độ acid cao hơn mức tối ưu). Do đó để cải tạo đất nhiễm phèn người ta thường bón vôi bột (CaO) do:
CaO + H2O → Ca(OH)2
Ca(OH)2 là base, sẽ trung hoà bớt acid trong đất nhiễm phèn, làm tăng pH của đất.
Câu 8:
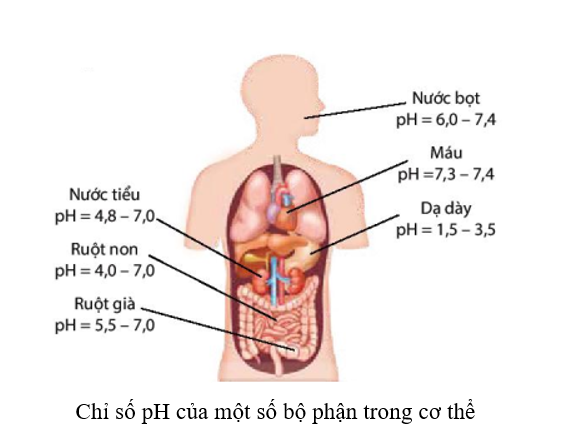
17/07/2024Em hãy tìm hiểu giá trị và ý nghĩa của chỉ số pH ở một số bộ phận trong cơ thể con người.
 Xem đáp án
Xem đáp án
Trong cơ thể của con người, máu và các dịch dạ dày, mật, … đều có giá trị pH trong một khoảng nhất định. Chỉ số pH trong cơ thể có liên quan đến tình trạng sức khoẻ. Nếu chỉ số pH tăng hoặc giảm đột ngột, không nằm trong giới hạn cho phép thì có thể là dấu hiệu ban đầu của bệnh lí, cần phải đi khám bệnh để tìm hiểu nguyên nhân. Ví dụ:
Chỉ số pH trong nước tiểu thường trong khoảng 4,8 – 7,0. Nếu pH nước tiểu cao trên 8,0, bệnh nhân có thể đang mắc một số bệnh như sỏi thận, nhiễm trùng đường tiết niệu, …
Nếu pH nước tiểu thấp dưới 5,0, nước tiểu có tính acid cao hơn bình thường, bệnh nhân có thể đang mắc bệnh tiểu đường, tiêu chảy, mất nước, …
Câu 9:
22/07/2024Để trung hoà 10 mL dung dịch HCl nồng độ x M cần 50 mL dung dịch NaOH 0,5 M. Xác định giá trị của x.
 Xem đáp án
Xem đáp án
Phương trình hoá học:
HCl + NaOH → NaCl + H2O
Theo phương trình hoá học ta có:
nHCl = nNaOH Þ
Câu 10:
23/07/2024Chuẩn độ dung dịch NaOH chưa biết chính xác nồng độ (biết nồng độ trong khoảng gần với 0,1 M) bằng dung dịch chuẩn HCl 0,1 M với chất chỉ thị phenolphthalein.
Chuẩn bị: Dung dịch HCl 0,1M, dung dịch NaOH (chưa biết chính xác nồng độ, khoảng 0,1 M), phenolphthalein, burette, bình tam giác 100 mL.
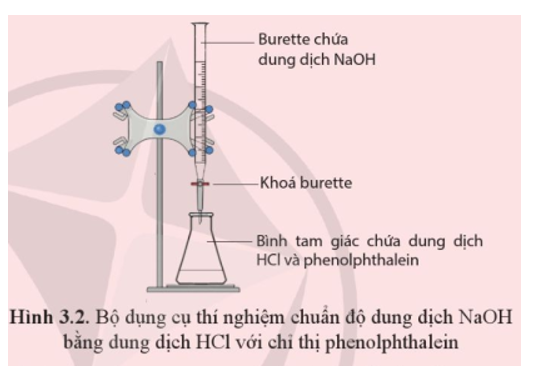
Tiến hành: Burette (loại 25 mL) đã được đổ đầy đến vạch 0 bằng dung dịch NaOH và chắc chắn không còn bọt khí trong burette. Cho 10 mL dung dịch chuẩn HCl vào bình tam giác (loại 100 mL), thêm 2 giọt chỉ thị phenolphthalein (loại 1% pha trong cồn).
Mở khoá burette để nhỏ từ từ từng giọt dung dịch NaOH vào bình tam giác, đồng thời lắc đều bình. Tiếp tục nhỏ dung dịch NaOH (vẫn duy trì lắc đều bình) cho tới khi dung dịch trong bình chuyển từ không màu sang hồng và bền trong ít nhất 20 giây thì kết thúc chuẩn độ (khoá burette). Ghi lại thể tích NaOH đã dùng. Lặp lại thí nghiệm ít nhất 3 lần.
Yêu cầu: Quan sát hiện tượng, viết phương trình hoá học và xác định nồng độ dung dịch NaOH.
 Xem đáp án
Xem đáp án
Hiện tượng: Ban đầu dung dịch trong bình tam giác không có màu. Mở khoá burette để nhỏ từ từ từng giọt dung dịch NaOH vào bình tam giác, đồng thời lắc đều bình thấy dung dịch trong bình chuyển từ không màu sang hồng.
Phương trình hoá học: NaOH + HCl → NaCl + H2O.
Xác định nồng độ dung dịch NaOH: Học sinh tự xác định theo kết quả chuẩn độ trên lớp.
Câu 11:
22/07/2024Giải thích vì sao trong thí nghiệm chuẩn độ dung dịch NaOH bằng dung dịch HCl, ta kết thúc chuẩn độ ngay khi dung dịch trong bình tam giác chuyển từ không màu sang hồng (bền trong ít nhất 20 giây).
 Xem đáp án
Xem đáp án
Trong thí nghiệm chuẩn độ dung dịch NaOH bằng dung dịch HCl, ta kết thúc chuẩn độ ngay khi dung dịch trong bình tam giác chuyển từ không màu sang hồng (bền trong ít nhất 20 giây) do đã đạt tới điểm tương đương.
Câu 12:
22/07/2024Giả sử khi kết thúc chuẩn độ, thể tích dung dịch NaOH (tính trung bình sau 3 lần chuẩn độ) đã sử dụng ở burette là 10,27 mL. Tính nồng độ của dung dịch NaOH.
 Xem đáp án
Xem đáp án
NaOH + HCl → NaCl + H2O
Ta có: VHCl. CHCl = VNaOH. CNaOH
Câu 13:
13/07/2024 Xem đáp án
Xem đáp án
Chuẩn bị:
- Bắp cải tím thái nhỏ (khoảng 100 g).
- Cốc thuỷ tinh 250 mL, nước sôi, đũa thuỷ tinh, lưới/ vải lọc.
- Các cốc (đã được dán nhãn) đựng các acid và base thích hợp.
- Giấy pH hoặc máy đo pH.
Tiến hành:
– Ngâm khoảng 100 g bắp cải tím đã được chuẩn bị vào 100 mL nước sôi trong khoảng 10 phút. Lọc bằng lưới lọc hoặc vải lọc, thu được dung dịch. Dung dịch này được sử dụng làm chất chỉ thị.
– Dùng máy đo pH (hoặc giấy pH) xác định pH của các dung dịch acid, base đã chuẩn bị.
- Cho vài giọt chất chỉ thị lần lượt vào các dung dịch acid, base đã chuẩn bị và khuấy đều. Quan sát sự đổi màu của các dung dịch.
Từ đó thiết lập được bảng màu của nước ép bắp cải tím theo pH như sau:

Câu 14:
15/07/2024Để xác định nồng độ của một dung dịch HCl, người ta tiến hành chuẩn độ bằng dung dịch NaOH 0,1 M. Để chuẩn độ 10 mL dung dịch HCl này cần 20 mL dung dịch NaOH. Xác định nồng độ của dung dịch HCl trên.
 Xem đáp án
Xem đáp án
NaOH + HCl → NaCl + H2O
Ta có: VHCl. CHCl = VNaOH. CNaOH
Câu 15:
17/07/2024Sưu tầm thông tin về ý nghĩa thực tiễn của pH trong đời sống và trong sản xuất nông nghiệp, công nghiệp.
 Xem đáp án
Xem đáp án
Chỉ số pH có ý nghĩa to lớn trong thực tiễn, pH có liên quan đến sức khoẻ con người, sự phát triển của động vật, thực vật, …
Trong cơ thể của con người, máu và các dịch của dạ dày, mật, … đều có giá trị pH trong một khoảng nhất định. Chỉ số pH trong cơ thể có liên quan đến tình trạng sức khoẻ. Nếu chỉ số pH tăng hoặc giảm đột ngột, không nằm trong giới hạn cho phép thì có thể là dấu hiệu ban đầu của bệnh lí, con người cần được khám để tìm ra nguyên nhân.
Một số động vật sống dưới nước cần có pH thích hợp, ví dụ tôm và cá ưa sống trong môi trường nước có pH khoảng 7,5 – 8,5 do đó cần thường xuyên theo dõi pH của nước để đảm bảo điều kiện sống thích hợp cho cá, tôm … đảm bảo hiệu quả nuôi trồng thuỷ sản …
Một số loại thực vật chỉ phát triển tốt trong đất có giá trị pH thích hợp, do đó cần cải tạo đất có pH phù hợp với loại cây đang trồng để đem lại hiệu quả kinh tế cao …
Trong đời sống hàng ngày, các sản phẩm như dầu gội, xà phòng, kem dưỡng da … cũng đều cần có giá trị pH trong một khoảng nhất định để an toàn với người sử dụng.
Câu 16:
15/07/2024Trong môi trường acid, diệp lục có màu vàng đến đỏ; còn trong môi trường kiềm, diệp lục có màu xanh.
a) Giải thích vì sao khi vắt chanh vào nước luộc rau muống thì màu xanh của nước lại bị nhạt đi.
b*) Vì sao khi luộc bánh chưng, cho thêm một chút thuốc muối (NaHCO3) sẽ làm cho lá dong gói bánh có màu xanh đẹp hơn?
 Xem đáp án
Xem đáp án
Trong môi trường acid, diệp lục có màu vàng đến đỏ; còn trong môi trường kiềm, diệp lục có màu xanh.
a) Khi vắt chanh vào nước luộc rau muống đã tạo môi trường acid cho nước luộc rau muống do đó màu xanh của nước luộc rau muống bị nhạt đi.
b) Trong nước, muối NaHCO3 bị thuỷ phân tạo môi trường base (kiềm):
Do đó, khi luộc bánh chưng, cho thêm một chút thuốc muối (NaHCO3) sẽ làm cho lá dong gói bánh có màu xanh đẹp hơn.
Câu 17:
22/07/2024Bình thường, chỉ số pH của nước tiểu ở người dao động trong khoảng 4,5 – 8,0. Nếu pH của nước tiểu giảm xuống dưới 4,5 thì có nghĩa là bị dư acid, còn cao hơn 8,0 thì có nghĩa là bị dư kiềm. Sỏi thận là khối khoáng chất nhỏ có thể tích tụ trong thận, gây đau khi ngăn cản dòng nước tiểu từ thận xuống liệu quản. Một trong các dấu hiệu của bệnh sỏi thận và nước tiểu bị dư acid hoặc dư kiềm. Đề xuất cách làm đơn giản để có thể tiên lượng bệnh sỏi thận.
 Xem đáp án
Xem đáp án
Để biết giá trị pH gần đúng của dung dịch, có thể sử dụng giấy chỉ thị pH.

Cách làm đơn giản để có thể tiên lượng bệnh sỏi thận:
Sử dụng giấy chỉ thị pH (có thể mua dễ dàng ở hiệu thuốc, cửa hàng hoá chất, shopee …) nhúng vào nước tiểu (ngay sau khi đi vệ sinh) sau đó tra với thang pH của giấy chỉ thị từ đó xác định được pH gần đúng của nước tiểu.
Nếu thấy pH của nước tiểu giảm xuống dưới 4,5 thì có nghĩa là bị dư acid, còn cao hơn 8,0 thì có nghĩa là bị dư kiềm.

