Giải SBT Hóa học 11 KNTT Bài 1: Khái niệm về cân bằng hóa học
Giải SBT Hóa học 11 KNTT Bài 1: Khái niệm về cân bằng hóa học
-
101 lượt thi
-
25 câu hỏi
-
0 phút
Danh sách câu hỏi
Câu 1:
22/07/2024 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Phản ứng thuận nghịch là phản ứng xảy ra theo 2 chiều ngược nhau là chiều thuận và chiều nghịch và được biểu diễn bằng hai nửa mũi tên ngược chiều ⇌.
Câu 2:
22/07/2024Cho 5 mol H2 và 5 mol I2 vào bình kín dung tích 1 lít và nung nóng đến 227oC. Đồ thị biểu diễn sự thay đổi nồng độ các chất theo thời gian được cho trong hình sau:

Nồng độ của HI ở trạng thái cân bằng là
A. 0,68 M.
B. 5,00 M.
C. 3,38 M.
D. 8,64 M.
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Phương trình phản ứng
Nhìn vào đồ thị ta thấy ở trạng thái cân bằng [H2] = [I2] = 0,68 M ; [HI] = 8,64M.
Câu 3:
23/07/2024Cho phản ứng hoá học sau:
Biểu thức hằng số cân bằng (Kc) của phản ứng trên là
A. .
B. .
C. .
D. .
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Biểu thức hằng số cân bằng (Kc) của phản ứng trên là
Câu 4:
22/07/2024Cho phản ứng hoá học sau:
Ở , nồng độ các chất ở trạng thái cân bằng như sau: .
Hằng số cân bằng Kc của phản ứng tại ToC là
A. 1,68.
B. 48,16.
C. 0,02.
D. 16,95.
 Xem đáp án
Xem đáp án
Đáp án đúng là: B
Hằng số cân bằng Kc của phản ứng tại ToC là :
= = 48,16
Câu 5:
22/07/2024Cho phản ứng hoá học sau:
Yếu tố nào sau đây cần tác động để cân bằng trên chuyển dịch sang phải?
A. Thêm chất xúc tác.
B. Giảm nồng độ N2 hoặc H2.
C. Tăng áp suất.
D. Tăng nhiệt độ.
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Khi tăng áp suất, cân bằng chuyển dịch theo chiều làm giảm áp suất tức là chuyển dịch theo chiều giảm số mol khí. Như vậy, khi tăng áp suất, cân bằng chuyển dịch theo chiều thuận (chuyển dịch sang phải).
Câu 6:
22/07/2024Cân bằng hoá học nào sau đây không bị chuyển dịch khi thay đổi áp suất?
A.
B.
C.
D.
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Khi thay đổi áp suất, cân bằng không bị chuyển dịch khi tổng số mol khí ở chất phản ứng bằng tổng số mol khí ở sản phẩm.
Câu 7:
22/07/2024Cho cân bằng hoá học sau:
Yếu tố nào sau đây cần tác động để cân bằng trên chuyển dịch sang phải?
A. Giảm nhiệt độ.
B. Tăng áp suất.
C. Giảm nồng độ của .
D. Thêm xúc tác Pt.
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
< 0, vậy đây là phản ứng tỏa nhiệt.
Khi giảm nhiệt độ, cân bằng chuyển dịch theo chiều làm tăng nhiệt độ tức là chiều thuận (chuyển dịch sang phải).
Câu 8:
23/07/2024Cho phản ứng hoá học sau: Phương án nào sau đây là nồng độ của các chất tại thời điểm cân bằng?
A. .
B. .
C. .
D. .
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Tại thời điểm cân bằng: = 4,84.10-3
Vậy cặp giá trị là phù hợp.
Câu 9:
22/07/2024Cho các phản ứng hoá học sau:
(1)
(2)
(3)
(4)
(5)
a) Các phản ứng toả nhiệt là
A. (1); (2) và (3).
B. (1) và (3).
C. (1), (2), (4) và (5).
D. (1); (2); (3) và (5).
 Xem đáp án
Xem đáp án
a) Đáp án đúng là: A
Phản ứng tỏa nhiệt là phản ứng có < 0.
Vậy các phản ứng tỏa nhiệt là (1); (2) và (3).
Câu 10:
22/07/2024b) Khi tăng nhiệt độ, các cân bằng hoá học chuyển dịch theo chiều thuận là
A. (1); (2) và (3).
B. (1); (2) và (5).
C. (4) và (5).
D. (3) và (5).
 Xem đáp án
Xem đáp án
b) Đáp án đúng là: C
Khi tăng nhiệt độ, các cân bằng hoá học chuyển dịch theo chiều làm giảm nhiệt độ, tức là chiều thu nhiệt. Các phản ứng thu nhiệt là các phản ứng có > 0.Vậy đó là các phản ứng (4) và (5).
Câu 11:
22/07/2024c) Khi tăng áp suất, các cân bằng hoá học chuyển dịch theo chiều thuận là
A. (1); (2) và (3).
B. (1); (3) và (5).
C. (2); (3) và (4).
D. (3); (4) và (5).
 Xem đáp án
Xem đáp án
c) Đáp án đúng là: A
Khi tăng áp suất, các cân bằng hoá học chuyển dịch theo chiều làm giảm áp suất, tức là giảm số mol khí. Vậy các phản ứng chuyển dịch theo chiều thuận khi tăng áp suất là phản ứng (1); (2) và (3).
Câu 12:
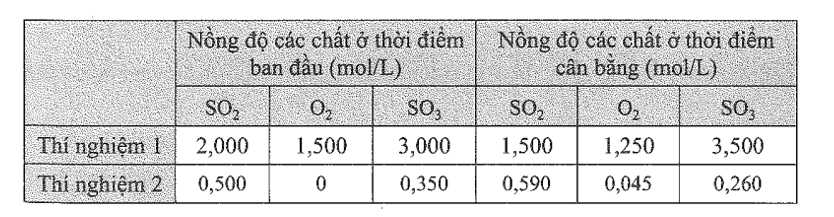
22/07/2024Các kết quả trong bảng sau đây được ghi lại từ hai thí nghiệm giữa khí sulfur dioxide và khí oxygen để tạo thành khí sulfur trioxide ở 600oC. Tính giá trị Kc ở hai thí nghiệm và nhận xét kết quả thu được.
 Xem đáp án
Xem đáp án
Hằng số cân bằng của phản ứng là:
Thí nghiệm 1: Kc = 4,355;
Thí nghiệm 2: Kc = 4,315.
Nhận xét: Giá trị Kc ở hai thí nghiệm gần bằng nhau, mặc dù nồng độ các chất khác nhau.
Câu 13:
22/07/2024Polystyrene là một loại nhựa thông dụng được dùng để làm đường ống nước. Nguyên liệu để sản xuất polystyrene là styrene (C6H5CH2CH3). Styrene được điều chế từ phản ứng sau:
Cân bằng hoá học của phản ứng trên sẽ chuyển dịch theo chiều nào nếu:
a) Tăng áp suất của bình phản ứng.
 Xem đáp án
Xem đáp án
a) Tăng áp suất của bình phản ứng: Cân bằng chuyển dịch theo chiều nghịch là chiều làm giảm số mol khí.
Câu 14:
22/07/2024b) Tăng nhiệt độ của phản ứng.
 Xem đáp án
Xem đáp án
b) Tăng nhiệt độ của phản ứng: Cân bằng chuyển dịch theo chiều thuận tức chiều phản ứng thu nhiệt.
Câu 15:
22/07/2024c) Tăng nồng độ của C6H5CH2CH3.
 Xem đáp án
Xem đáp án
c) Tăng nồng độ của C6H5CH2CH3: Cân bằng chuyển dịch theo chiều thuận, là chiều làm giảm nồng độ của C6H5CH2CH3.
Câu 16:
22/07/2024d) Thêm chất xúc tác.
 Xem đáp án
Xem đáp án
d) Thêm chất xúc tác: Cân bằng không chuyển dịch. Chất xúc tác chỉ làm tăng tốc độ của cả phản ứng thuận và phản ứng nghịch, làm phản ứng nhanh đạt đến trạng thái cân bằng.
Câu 17:
22/07/2024e) Tách styrene ra khỏi bình phản ứng.
 Xem đáp án
Xem đáp án
e) Tách styrene ra khỏi bình phản ứng: Cân bằng chuyển dịch theo chiều thuận, là chiều làm tăng nồng độ styrene.
Câu 19:
23/07/2024Trong một bình kín xảy ra cân bằng hoá học sau:
Cho 1 mol H2 và 1 mol I2 vào bình kín, dung tích 2 lít. Lượng HI tạo thành theo thời gian được biểu diễn bằng đồ thị sau:
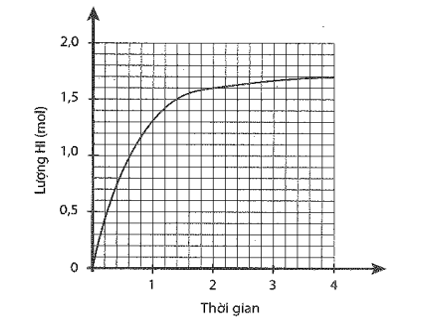
a) Xác định nồng độ các chất ở thời điểm cân bằng.
 Xem đáp án
Xem đáp án
a) Số mol HI tại thời điểm cân bằng là 1,7 mol Số mol H2 và I2 phản ứng là 0,85 mol. Nồng độ các chất tại thời điểm cân bằng:
[H2] = [I2] = = 0,075 (mol/L)
[HI] = (mol/L)
Câu 20:
22/07/2024b) Tính hằng số cân bằng KC.
 Xem đáp án
Xem đáp án
b)
Lượng chất ban đầu : 1 1 0 (mol)
Lượng chất phản ứng: 0,85 0,85 1,7 (mol)
Nồng độ tại cân bằng: (mol/L)
Hằng số cân bằng (Kc):
Câu 22:
22/07/2024Khi xăng cháy trong động cơ ô tô sẽ tạo ra nhiệt độ cao, lúc đó N2 phản ứng với O2 tạo thành NO:
NO khi được giải phóng ra không khí nhanh chóng kết hợp với O2 tạo thành NO2 là một khí gây ô nhiễm môi trường. Ở 2000oC, hằng số cân bằng Kc của phản ứng (1) là 0,01.
Nếu trong bình kín dung tích 1 lít có 4 mol N2 và 0,1 mol O2 thì ở 2000oC lượng khí NO tạo thành là bao nhiêu (giả thiết NO chưa phản ứng với O2 )?
 Xem đáp án
Xem đáp án
Phương trình phản ứng: N2(g) + O2(g) ⇌ 2NO(g)
Ban đầu: 4 0,1 0 (mol/L)
Cân bằng: 2x (mol/L)
Hằng số cân bằng
Vậy số mol khí NO tạo thành là: 2x.1 = 0,054 (mol)
Câu 23:
23/07/2024Trong dung dịch muối CoCl2 (màu hồng) tồn tại cân bằng hoá học sau:
màu hồng màu xanh
Dự đoán sự biến đổi màu sắc của ống nghiệm đựng dung dịch CoCl2 trong các trường hợp sau:
a) Thêm từ từ HCl đặc.
 Xem đáp án
Xem đáp án
Xét cân bằng:
màu hồng màu xanh
a) Thêm HCl: Cân bằng chuyển dịch theo chiều làm giảm nồng độ [Cl-], tức là chuyển dịch theo chiều thuận, dung dịch chuyển màu xanh.
Câu 24:
22/07/2024b) Ngâm ống nghiệm vào cốc nước nóng.
 Xem đáp án
Xem đáp án
b) Ngâm ống nghiệm vào cốc nước nóng: Cân bằng chuyển dịch theo chiều thuận (chiều thu nhiệt), dung dịch chuyển màu xanh.
Câu 25:
23/07/2024c) Thêm một vài giọt dung dịch AgNO3.
 Xem đáp án
Xem đáp án
c) Thêm một vài giọt dung dịch AgNO3: Ag+ + Cl- → AgCl (kết tủa trắng), nồng độ Cl- giảm, cân bằng chuyển dịch theo chiều nghịch, dung dịch màu hồng.

