Giải SBT Hóa 10 Bài 5. Cấu tạo bảng tuần hoàn các nguyên tố hóa học có đáp án
Giải SBT Hóa 10 Bài 5. Cấu tạo bảng tuần hoàn các nguyên tố hóa học có đáp án
-
51 lượt thi
-
20 câu hỏi
-
40 phút
Danh sách câu hỏi
Câu 1:
23/07/2024 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: A
Cấu hình electron của X là: 1s22s22p63s2.
Vậy số hiệu nguyên tử của X = số electron = 12.
Câu 2:
15/07/2024Chu kì là
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: C
Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, được xếp theo chiều điện tích hạt nhân nguyên tử tăng dần.
Câu 3:
14/07/2024Nhóm nguyên tố là
 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: C
Nhóm nguyên tố là tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau, do đó có tính chất hóa học gần giống nhau và được xếp thành một cột.
Câu 4:
17/07/2024 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: D
Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn:
+ Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
+ Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp vào cùng một chu kì.
+ Các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau được xếp cùng một nhóm.
Câu 5:
13/07/2024 Xem đáp án
Xem đáp án
Lời giải:
Đáp án đúng là: B
Trong hạt nhân nguyên tử không có chứa electron.
Câu 6:
19/07/2024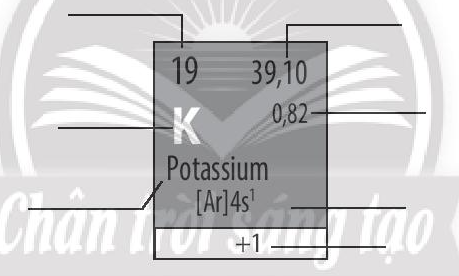
 Xem đáp án
Xem đáp án
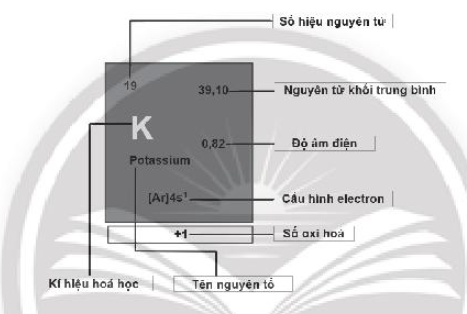
Câu 7:
17/07/2024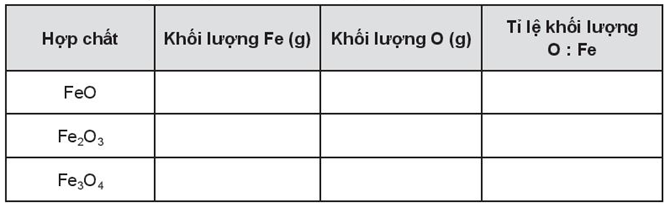
 Xem đáp án
Xem đáp án
Lời giải:
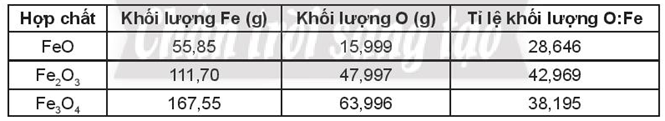
Câu 8:
19/07/2024 Xem đáp án
Xem đáp án
Lời giải:
Các nguyên tố ở chu kì 3 có 3 lớp electron. Lớp thứ 3 có 3 phân lớp là 3s, 3p và 3d. Do trật tự phân mức năng lượng là: 1s 2s 2p 3s 3p 4s 3d … nên chu kì 3 chỉ có 8 nguyên tố ứng với số electron trên lớp thứ 3 thay đổi từ 1 đến 8 hay cấu hình electron thay đổi từ 3s13p0 đến 3s23p6.
Câu 9:
13/07/2024Xác định vị trí của nguyên tố (ô, chu kì và nhóm) của nguyên tố có:
Số hiệu nguyên tử là 20, là nguyên tố giúp xương chắc khỏe, phòng ngừa những bệnh loãng xương, giảm tình trạng đau nhức và khó khăn trong vận động, làm nhanh lành các vết nứt gãy trên xương.
 Xem đáp án
Xem đáp án
Lời giải:
Z = 20, cấu hình electron: 1s22s22p63s23p64s2
Nguyên tố này thuộc ô 20 (Z = 20); chu kì 4 (do có 4 lớp electron); nhóm IIA (do nguyên tố s, 2 electron lớp ngoài cùng).
Câu 10:
21/07/20249 electron, được sử dụng để điều chế một số dẫn xuất hydrocarbon, làm sản phẩm trung gian để sản xuất ra chất dẻo.
 Xem đáp án
Xem đáp án
Lời giải:
Nguyên tử có 9 electron nên Z = 9, cấu hình electron: 1s22s22p5
Nguyên tố này thuộc ô 9 (Z = 9); chu kì 2 (do có 2 lớp electron); nhóm VIIA (do nguyên tố p, 7 electron lớp ngoài cùng).
Câu 11:
21/07/2024 Xem đáp án
Xem đáp án
Lời giải:
Nguyên tử có 28 proton nên Z = 28, cấu hình electron: 1s22s22p63s23p63d84s2.
Nguyên tố này thuộc ô 28 (Z = 28), chu kì 4 (do có 4 lớp electron), nhóm VIIIB (do nguyên tố d, có tổng số electron trên 2 phân lớp 3d và 4s là 10).
Câu 12:
23/07/2024 Xem đáp án
Xem đáp án
Lời giải:
Z = A – N = 52 – 28 = 24, cấu hình electron: 1s22s22p63s23p63d54s1
Nguyên tố này thuộc ô 24 (Z = 24), chu kì 4 (do có 4 lớp electron), nhóm VIB (do có 6 electron hóa trị).
Câu 13:
23/07/2024Viết cấu hình electron nguyên tử của các nguyên tố và xác định tên nguyên tố:
Chu kì 3, nhóm IIIA được dùng trong ngành công nghiệp chế tạo, cụ thể là tạo ra các chi tiết cho xe ô tô, xe tải, tàu hỏa, tàu biển và cả máy bay.
 Xem đáp án
Xem đáp án
Lời giải:
Nguyên tố thuộc chu kì 3 nên có 3 lớp electron; thuộc nhóm IIIA nên có 3 electron lớp ngoài cùng:
Cấu hình electron: 1s22s22p63s23p1, Z = 13, nguyên tố nhôm, Al (hay aluminium).
Câu 14:
19/07/2024 Xem đáp án
Xem đáp án
Lời giải:
Nguyên tố thuộc chu kì 4 nên có 4 lớp electron; thuộc nhóm IB nên có 1 electron hóa trị, nguyên tố d.
Cấu hình electron có thể có:
+ Trường hợp 1: 1s22s22p63s23p63d54s1, Z = 24, nguyên tố là chromine (loại).
+ Trường hợp 2: 1s22s22p63s23p63d104s1, Z = 29, nguyên tố copper (thỏa mãn).
Dựa vào các ứng dụng của nguyên tố, thấy trường hợp 2 thỏa mãn.
Câu 15:
22/07/2024Một hợp chất có công thức XY2, trong đó X chiếm 50% về khối lượng. Trong hạt nhân của X và Y đều có số proton bằng số neutron. Tổng số proton trong phân tử XY2 là 32. Hợp chất này được sử dụng như chất trung gian để sản xuất sulfuric acid.
Viết cấu hình electron của X và Y
 Xem đáp án
Xem đáp án
Lời giải:
a) Gọi số hạt proton, neutron và electron của nguyên tử X là p, n, e và hạt proton, neutron và electron của nguyên tử Y là p’; n’; e’.
Theo bài ta ta có:\[\left\{ \begin{array}{l}p = n = e\\p' = n' = e'\end{array} \right.\]
Một cách gần đúng ta có: Mx = 2p; MY = 2p’.
Lại có trong XY2, X chiếm 50% về khối lượng nên:
\[\frac{{{M_X}}}{{2{M_Y}}} = \frac{{50}}{{50}} = 1\,hay\,\frac{{2p}}{{4p'}} = 1 \Rightarrow p = 2{p^'}\,\,\,\,(1)\]
Tổng số proton trong phân tử XY2 là 32 nên: p + 2p’ = 32 (2)
Từ (1) và (2) giải hệ phương trình được: p = 16 và p’ = 8.
p = 16 nên ZX = 16, X có cấu hình electron: 1s22s22p63s23p4
p’ = 8 nên ZY = 8, Y có cấu hình electron: 1s22s22p4
Câu 16:
18/07/2024 Xem đáp án
Xem đáp án
Lời giải:
X ở ô thứ 16 (do Z = 16), chu kì 3 (do có 3 lớp electron), nhóm VIA (do nguyên tố p, 6 electron lớp ngoài cùng); X là sulfur (S).
Y ở ô thứ 8 (do Z = 8), chu kì 2 (do có 2 lớp electron), nhóm VIA (do nguyên tố p, 6 electron lớp ngoài cùng); Y là oxygen (O).
Công thức phân tử hợp chất XY2 là SO2.
Câu 17:
16/07/2024Hai nguyên tố X và Y đứng kế tiếp nhau trong cùng một chu kì, có tổng số điện tích hạt nhân bằng 25.
a. Hãy viết cấu hình electron của nguyên tử X, Y.
b. Xác định vị trí của X, Y trong bảng tuần hoàn và tên nguyên tố X, Y.
 Xem đáp án
Xem đáp án
Lời giải:
a) X và Y đứng kế tiếp nhau trong cùng một chu kì nên số proton của chúng chỉ khác nhau 1 đơn vị.
Giả sử ZX < ZY, ta có ZY = ZX + 1 (1)
Theo bài ra, tổng số điện tích hạt nhân của X và Y là 25 nên:
ZX + ZY = 25 (2)
Từ (1) và (2) có ZX = 12 và ZY = 13.
Cấu hình electron của X là: 1s22s22p63s2;
Cấu hình electron của Y là: 1s22s22p63s23p1.
b)
+ X ở ô thứ 12 (do Z = 12); chu kì 3 (do có 3 lớp electron); nhóm IIA (do nguyên tố s, 2 electron lớp ngoài cùng). X là magnesium (Mg).
+ Y ở ô thứ 13 (do Z = 13); chu kì 3 (do có 3 lớp electron); nhóm IIIA (do nguyên tố p, 3 electron ở lớp ngoài cùng). Y là aluminium (Al).
Câu 18:
20/07/2024 Xem đáp án
Xem đáp án
Lời giải:
Gọi ZX, ZY lần lượt là số proton của nguyên tử nguyên tố X và Y. Ta có:
ZX + ZY = 32 (1)
Vì X và Y thuộc cùng nhóm A ở hai chu kì kế tiếp nhau nên số proton của chúng khác nhau 8, 18 hoặc 32 đơn vị.
Giả sử ZY > ZX.
Trường hợp 1: ZY – ZX = 8 (2)
Kết hợp (1) và (2) giải hệ phương trình ta được: ZX = 12; ZY = 20.
Cấu hình electron của X: 1s22s22p63s2 (nhóm IIA).
Cấu hình electron của Y: 1s22s22p63s23p64s2 (nhóm IIA).
Vậy trường hợp 1 thỏa mãn, X là magnesium (Mg) và Y là calcium (Ca).
Trường hợp 2: ZY – ZX = 18 (3)
Kết hợp (1) và (3) giải hệ phương trình ta được: ZX = 7; ZY = 25.
Cấu hình electron của X: 1s22s22p3 (nhóm VA)
Cấu hình electron của Y: 1s22s22p63s23p63d54s2 (nhóm VIIB)
Vậy trường hợp 2 không thỏa mãn.
Trường hợp 3: ZY – ZX = 32 (4)
Kết hợp (1) và (4) giải hệ phương trình ta được: ZX = 0; ZY = 32.
Vậy trường hợp 3 không thỏa mãn.
Câu 19:
17/07/2024X và Y là hai nguyên tố thuộc chu kì nhỏ, thuộc hai nhóm A kế tiếp nhau trong bảng tuần hoàn. Ở trạng thái đơn chất, X và Y phản ứng được với nhau. Tổng số proton trong hạt nhân nguyên tử của X và Y là 23. Biết rằng X đứng sau Y trong bảng tuần hoàn. Xác định tên nguyên tố X, Y.
 Xem đáp án
Xem đáp án
Lời giải:
Gọi số proton của X và Y lần lượt là ZX và ZY. Do X đứng sau Y trong bảng tuần hoàn nên ZX > ZY.
Tổng số proton trong hạt nhân nguyên tử của X và Y là 23 nên: ZX + ZY = 23 (1).
X và Y là 2 nguyên tố thuộc 2 nhóm kế tiếp trong bảng tuần hoàn nên số proton của X và Y hơn kém nhau 1 hoặc 7 hoặc 9.
Kết hợp (1) và (2) được ZX = 12 và ZY = 11. X là Mg (magnesium) và Y là Na (sodium).
Ở trạng thái đơn chất, hai nguyên tố này không phản ứng được với nhau (loại).
Trường hợp 2: ZX – ZY = 7 (3)
Kết hợp (1) và (3) được ZX = 15 và ZY = 8. X là P (phosphorus) và Y là O (oxygen).
Ở trạng thái đơn chất, hai nguyên tố này phản ứng được với nhau (nhận).
Trường hợp 3: ZX – ZY = 9 (4)
Kết hợp (1) và (4) được ZX = 16 và ZY = 7. X là S (sulfur) và Y là N (nitrogen).
Ở trạng thái đơn chất, hai nguyên tố này không phản ứng được với nhau (loại).
Vậy X là P (phosphorus) và Y là O (oxygen).
Câu 20:
23/07/2024 Xem đáp án
Xem đáp án
Lời giải:
Kết tủa là AgCl;
\[{n_{AgCl}} = \frac{{18,655}}{{143,5}} = 0,13\,(mol)\]
Phương trình hóa học:
\[\begin{array}{l}\overline M Cl\, + \,AgN{O_3} \to \,AgCl + \overline M N{O_3}\\0,13\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,13\,\,\,\,\,\,\,\,mol\\ \Rightarrow (\overline M + 35,5).0,13 = 6,645 \Rightarrow \overline M = 15,62\end{array}\]
Do hai kim loại kiềm ở hai chu kì kế tiếp nhau, nên 2 kim loại là lithium (M = 7) và sodium (M = 23).
