Giải SBT Hóa 10 Bài 14: Phản ứng hóa học và enthalpy có đáp án
Giải SBT Hóa 10 Bài 14: Phản ứng hóa học và enthalpy có đáp án
-
173 lượt thi
-
16 câu hỏi
-
40 phút
Danh sách câu hỏi
Câu 1:
14/07/2024Những phát biểu nào sau đây là đúng?
A. Tất cả các phản ứng cháy đều toả nhiệt.
B. Phản ứng toả nhiệt là phản ứng giải phóng năng lượng dưới dạng nhiệt.
C. Tất cả các phản ứng mà chất tham gia có chứa nguyên tố oxygen đều toả nhiệt.
D. Phản ứng thu nhiệt là phản ứng hấp thụ năng lượng dưới dạng nhiệt.
E. Lượng nhiệt mà phản ứng hấp thụ hay giải phóng không phụ thuộc vào điều kiện thực hiện phản ứng và thể tồn tại của chất trong phản ứng.
G. Sự cháy của nhiên liệu (xăng, dầu, khí gas, than, gỗ,...) là những ví dụ về phản ứng thu nhiệt vì cần phải khơi mào.
 Xem đáp án
Xem đáp án
Đáp án đúng là: A, B, D
C sai vì phản ứng CaCO3 → CaO + CO2 là phản ứng thu nhiệt.
E sai vì lượng nhiệt mà phản ứng hấp thụ hay giải phóng phụ thuộc vào điều kiện thực hiện phản ứng và thể tồn tại của chất trong phản ứng. Ví dụ:
Nhưng phản ứng:
G sai vì sự cháy của nhiên liệu là những ví dụ về phản ứng tỏa nhiệt. Việc khơi mào ban đầu là cung cấp nhiệt ban đầu cho sự cháy nhưng sau đó phản ứng cháy có thể tự tiếp diễn và tỏa rất nhiều nhiệt.
Câu 2:
14/07/2024Những phát biểu nào sau đây là không đúng?
A. Trong phòng thí nghiệm, có thể nhận biết một phản ứng thu nhiệt hoặc toả nhiệt bằng cách đo nhiệt độ của phản ứng bằng một nhiệt kế.
B. Nhiệt độ của hệ phản ứng sẽ tăng lên nếu phản ứng thu nhiệt.
C. Nhiệt độ của hệ phản ứng sẽ tăng lên nếu phản ứng toả nhiệt.
D. Nhiệt độ của hệ phản ứng sẽ giảm đi nếu phản ứng toả nhiệt.
E. Nhiệt độ của hệ phản ứng sẽ giảm đi nếu phản ứng thu nhiệt.
 Xem đáp án
Xem đáp án
Đáp án đúng là: B, D
Phát biểu B sai vì: Nhiệt độ của hệ phản ứng sẽ giảm đi nếu phản ứng thu nhiệt.
Phát biểu D sai vì: Nhiệt độ của hệ phản ứng sẽ tăng lên nếu phản ứng toả nhiệt.
Câu 3:
15/07/2024Phát biểu nào sau đây đúng?
 Xem đáp án
Xem đáp án
Đáp án đúng là: A
Điều kiện chuẩn là điều kiện ứng với áp suất 1 bar (với chất khí), nồng độ 1 mol L-1 (đối với chất tan trong dung dịch) và nhiệt độ thường được chọn là 298 K.
Câu 4:
13/07/2024Mỗi quá trình sau đây là thu nhiệt hay tỏa nhiệt?
(1) H2O (lỏng, ở 25oC) → H2O (hơi, ở 100oC)
(2) H2O (lỏng, ở 25oC) → H2O (rắn, ở 0oC).
(3) CaCO3 (Đá vôi) CaO + CO2.
(4) Khí methane (CH4) cháy trong oxygen.
 Xem đáp án
Xem đáp án
Quá trình (1) thu nhiệt;
Quá trình (2) tỏa nhiệt;
Quá trình (3) thu nhiệt;
Quá trình (4) tỏa nhiệt.
Chú ý:
+ Phản ứng giải phóng năng lượng dưới dạng nhiệt là phản ứng tỏa nhiệt;
+ Phản ứng hấp thụ năng lượng dưới dạng nhiệt là phản ứng thu nhiệt.
Câu 5:
18/07/2024Biết rằng ở điều kiện chuẩn, 1 mol enthanol cháy tỏa ra một nhiệt lượng là 1,37 × 103 kJ. Nếu đốt cháy hoàn toàn 15,1 gam ethanol, năng được được giải phóng ra dưới dạng nhiệt bởi phản ứng là
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Nếu đốt cháy hoàn toàn 15,1 gam ethanol, năng được được giải phóng ra dưới dạng nhiệt bởi phản ứng là
Câu 6:
20/07/2024Chọn câu trả lời đúng.
Enthalpy tạo thành chuẩn của một đơn chất bền
 Xem đáp án
Xem đáp án
Đáp án đúng là: D
Enthalpy tạo thành chuẩn của một đơn chất bền bằng 0.
Câu 7:
20/07/2024Những phát biểu nào sau đây đúng?
A. Biến thiên enthalpy chuẩn của một phản ứng hoá học là lượng nhiệt kèm theo phản ứng đó ở áp suất 1 atm và 25oC.
B. Nhiệt (toả ra hay thu vào) kèm theo một phản ứng được thực hiện ở 1 bar và 298 K là biến thiên enthalpy chuẩn của phản ứng đó.
C. Một số phản ứng khi xảy ra làm môi trường xung quanh nóng lên là phản ứng thu nhiệt.
D. Một số phản ứng khi xảy ra làm môi trường xung quanh lạnh đi là do các phản ứng này thu nhiệt và lấy nhiệt từ môi trường.
 Xem đáp án
Xem đáp án
Đáp án đúng là: B và D
A sai vì: Biến thiên enthalpy chuẩn của một phản ứng hoá học là lượng nhiệt kèm theo phản ứng đó ở áp suất 1 bar và 25oC.
C sai vì: Một số phản ứng khi xảy ra làm môi trường xung quanh nóng lên là phản ứng tỏa nhiệt.
Câu 8:
23/07/2024Cho hai phản ứng cùng xảy ra ở điều kiện chuẩn:
(1) N2(g) + O2(g) → 2NO(g)
(2)
Những phát biểu nào sau đây không đúng?
A. Enthalpy tạo thành chuẩn của NO là
B. Enthalpy tạo thành chuẩn của NO2 là
C. Biến thiên enthalpy chuẩn của phản ứng giữa 1 mol N2 với 1 mol O2 tạo thành 2 mol NO là
D. Biến thiên enthalpy chuẩn của phản ứng giữa 1 mol khí NO với 0,5 mol khí O2 tạo thành 1 mol khí NO2 là
E. Enthalpy tạo thành chuẩn của NO2 (g) là:
 Xem đáp án
Xem đáp án
Đáp án đúng là: B, C
Phát biểu B sai vì: Enthalpy tạo thành chuẩn của NO2 là lượng nhiệt kèm theo của phản ứng tạo thành 1 mol NO2 từ các đơn chất N2 và O2 trong điều kiện chuẩn.
Phát biểu C sai vì: Biến thiên enthalpy chuẩn của phản ứng giữa 1 mol N2 với 1 mol O2 tạo thành 2 mol NO là
Câu 9:
23/07/2024Phản ứng phân hủy 1 mol H2O (g) ở điều kiện tiêu chuẩn:
cần cung cấp một nhiệt lượng là 241,8 kJ.
Điền vào chỗ trống trong các phát biểu dưới đây:
a) Phản ứng (1) là phản ứng …… nhiệt.
 Xem đáp án
Xem đáp án
a) Phản ứng (1) là phản ứng thu nhiệt.
Câu 10:
17/07/2024b) Nhiệt tạo thành chuẩn của H2O (g) là ……..
 Xem đáp án
Xem đáp án
b) Nhiệt tạo thành chuẩn của H2O (g) là -241,8 kJ mol-1.
Câu 11:
23/07/2024c) Biến thiên enthalpy chuẩn của phản ứng 2H2(g) + O2(g) → 2H2O(g) là …….
 Xem đáp án
Xem đáp án
c) Biến thiên enthalpy chuẩn của phản ứng 2H2(g) + O2(g) → 2H2O(g) là -483,6 kJ.
Câu 12:
16/07/2024d) Biến thiên enthalpy chuẩn của phản ứng (1) là ………
 Xem đáp án
Xem đáp án
d) Biến thiên enthalpy chuẩn của phản ứng (1) là 248,1 kJ.
Câu 13:
18/07/2024Phương trình hóa học nào dưới đây biểu thị enthalpy tạo thành chuẩn của CO(g)?
A. 2C(than chì) + O2(g) → 2CO(g)
B. C(than chì) + O(g) → CO(g)
C. C(than chì) +
D. C(than chì) + CO2(g) → 2CO(g)
E. CO(g) → C(than chì) + O(g).
 Xem đáp án
Xem đáp án
Đáp án đúng là: C
Enthalpy tạo thành chuẩn (hay nhiệt tạo thành chuẩn) của một chất là lượng nhiệt kèm theo của phản ứng tạo thành 1 mol chất đó từ các đơn chất dạng bền nhất trong điều kiện chuẩn.
Vậy phương trình biểu thị enthalpy tạo thành chuẩn của CO(g) là:
C(than chì) +
Câu 14:
13/07/2024Khi pha loãng 100 mL H2SO4 đặc bằng nước thấy cốc đựng dung dịch nóng lên. Vậy quá trình pha loãng H2SO4 đặc là quá trình thu nhiệt hay tỏa nhiệt?
Theo em, khi pha loãng H2SO4 đặc nên cho từ từ H2SO4 đặc vào nước hay ngược lại? Vì sao?
 Xem đáp án
Xem đáp án
Khi pha loãng 100 mL H2SO4 đặc bằng nước thấy cốc đựng dung dịch nóng lên. Vậy quá trình pha loãng H2SO4 đặc là quá trình tỏa nhiệt.
Để pha loãng H2SO4 đặc an toàn cần cho từ từ H2SO4 đặc vào nước và khuấy nhẹ bằng đũa thủy tinh. Tuyệt đối không làm ngược lại vì phản ứng tỏa nhiệt mạnh, làm nước sôi đột ngột kéo theo những giọt acid bắn ra ngoài gây nguy hiểm.
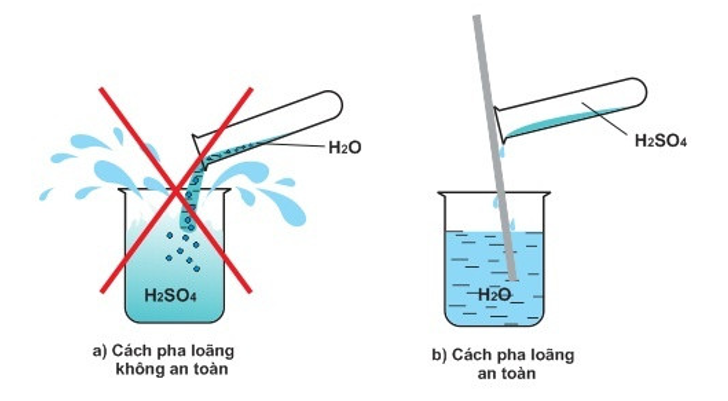
Câu 15:
23/07/2024Nhiệt tỏa ra khi đốt cháy 1 gam một mẫu than là 23,0 kJ. Giả thiết rằng toàn bộ lượng nhiệt của quá trình đốt than tỏa ra đều dùng để làm nóng nước, không có sự thất thoát nhiệt, hãy tính lượng than cần phải đốt để làm nóng 500 gam nước từ 20oC tới 90oC. Biết để làm nóng 1 mol nước thêm 1oC cần một nhiệt lượng là 75,4 J.
 Xem đáp án
Xem đáp án
Lượng nhiệt cần để làm nóng 500 gam nước từ 20oC tới 90oC là:
Lượng than cần phải đốt là:
Câu 16:
19/07/2024Ethanol sôi ở 78,29oC. Để làm 1 gam ethanol lỏng nóng thêm 1 oC cần một nhiệt lượng là 1,44J; để 1 gam ethanol hóa hơi (ở 78,29oC) cần một nhiệt lượng là 855 J. Hãy tính nhiệt lượng cần cung cấp để làm nóng 1 kg ethanol từ 20,0 oC đến nhiệt độ sôi và hóa hơi hoàn toàn ở nhiệt độ đó.
 Xem đáp án
Xem đáp án
1kg = 1000g
Nhiệt lượng cần cung cấp để làm nóng 1 kg ethanol từ 20,0 oC đến nhiệt độ sôi là:
1000 × 1,44 × (78,29 – 20) = 83 937,6 (J)
Nhiệt lượng cần cung cấp để hóa hơi hoàn toàn 1 kg ethanol ở nhiệt độ sôi là:
855 × 1000 = 855 000 (J)
Nhiệt lượng cần cung cấp để làm nóng 1 kg ethanol từ 20,0 oC đến nhiệt độ sôi và hóa hơi hoàn toàn ở nhiệt độ đó là:
83 937,6 + 855 000 = 938 937,6 (J)
