125 câu trắc nghiệm Oxi - Lưu huỳnh nâng cao
125 câu trắc nghiệm Oxi - Lưu huỳnh nâng cao (P3)
-
536 lượt thi
-
25 câu hỏi
-
20 phút
Danh sách câu hỏi
Câu 1:
22/07/2024Phát biểu nào sau đây không đúng?
 Xem đáp án
Xem đáp án
Đáp án D.
H2S + Cu(NO3)2 → CuS + 2HNO3
Câu 2:
12/07/2024Trong 5,6 gam bột sắt với 2,4 gam bột lưu huỳnh rồi nung nóng (trong điều kiện không có không khí), thu được hỗn hợp rắn M. Cho M tác dụng với lượng dư dung dịch HCl, giải phóng hỗn hợp khí X và còn lại một phần không tan G. Để đốt cháy hoàn toàn X và G cần vừa đủ V lít khí O2(đktc). Giá trị của V là:
 Xem đáp án
Xem đáp án
Đáp án A.

Câu 3:
21/07/2024Nung nóng hỗn hợp bột X gồm a mol Fe và b mol S trong khí trơ, hiệu suất phản ứng bằng 50%, thu được hỗn hợp rắn Y. Cho Y vào dung dịch HCl dư, sau khi các phản ứng xảy ra hoàn toàn, thu được hỗn hợp khí Z có tỉ khối so với H2 bằng 5. Tỉ lệ a:b bằng:
 Xem đáp án
Xem đáp án
Đáp án A.
Câu 4:
20/07/2024Để phân biệt được 3 chất khí: CO2, SO2 và O2 đựng trong 3 bình mất nhãn riêng biệt, người ta dùng thuốc thử là:
 Xem đáp án
Xem đáp án
Đáp án C.
Chất làm mất màu dung dịch brom là SO2.
SO2 + Br2 + 2H2O→ 2HBr + H2SO4
Chất làm đục nước vôi trong là CO2
CO2 + Ca(OH)2 → CaCO3 + H2O
Còn lại là O2
Câu 5:
17/07/2024Có thể dùng H2SO4 đặc để làm khô tất cả các khí trong dãy nào?
 Xem đáp án
Xem đáp án
Đáp án C.
Nguyên tắc làm khô là H2SO4 đặc không phản ứng với chất được làm khô
Câu 6:
14/07/2024Dẫn 8,96 lít (đktc) hỗn hợp khí X gồm H2S và CO2 vào lượng dư dung dịch Pb(NO3)2, thu được 23,9 gam kết tủa. Thành phần phần trăm thể tích của H2S trong X là:
 Xem đáp án
Xem đáp án
Đáp án A
nX = 0,4 (mol)
n↓ = nPbS = 0,1 (mol)
Pb(NO3)2 + H2S →PbS + 2HNO3
Câu 7:
23/07/2024Cho hỗn hợp khí oxi và ozon, sau một thời gian ozon bị phân hủy hết (2O3 → 3O2) thì thể tích khí tăng lên so với ban đầu là 2 lít. Thể tích của ozon trong hỗn hợp ban đầu là:
 Xem đáp án
Xem đáp án
Đáp án A.
2 O3 →3 O2
2lít O3 → 3lít O2 Vtăng = 1 lít
X lít O3 → Vtăng = 2 lít
=> X = 4
Câu 8:
20/07/2024Hỗn hợp khí A gồm có O2 và O3, tỉ khối của hỗn hợp khí A đối với hiđro là 19,2. Hỗn hợp khí B gồm H2 và CO, tỉ khối của hỗn hợp khí B đối với hiđro là 3,6. Thành phần phần trăm theo thể tích của H2 và O2 lần lượt là?
 Xem đáp án
Xem đáp án
Đáp án A
Câu 9:
09/07/2024Cho các cặp phản ứng sau:
(1) H2S + Cl2 + H2O →
(2) SO2 + H2S →
(3) SO2 + Br2 + H2O →
(4) S + H2SO4 đặc, nóng →
(5) S + F2 →
(6) SO2 + O2 →
Tổng số phản ứng tạo ra sản phẩm chứa lưu huỳnh ở mức oxi hóa +6 là:
 Xem đáp án
Xem đáp án
Đáp án C.
(1) H2S + 4Cl2 + 4H2O → H2SO4 + 8HCl
(3) SO2 + Br2 + 2H2O → 2HBr + H2SO4
(5) S + 3F2 → SF6
(6) 2SO2 + O2 2SO3
Câu 10:
21/07/2024Dẫn 2,24 lít khí SO2 (đktc) vào 200ml dung dịch KOH 1,5M. Vậy khi phản ứng xảy ra hoàn toàn thì thu được:
 Xem đáp án
Xem đáp án
Đáp án C.
Tạo K2SO3
SO2 + 2KOH → K2SO3 + H2O
0,1 0,2 0,1
nKOH dư = 0,1 mol
=> CKOH = 0,5M,
Câu 11:
16/07/2024Hỗn hợp khí X gồm O2 và O3, tỉ khối hơi của X đối với H2 là 19,2. Đốt cháy hoàn toàn a mol khí CO cần 1 mol X. Giá trị của a là:
 Xem đáp án
Xem đáp án
Đáp án C.
Câu 12:
19/07/2024Cho các cặp chất sau:
(1) Khí Cl2 và khí O2.
(2) Khí H2S và khí SO2.
(3) Khí H2S và dung dịch Pb(NO3)2.
(4) CuS và dung dịch HCl.
(5) Khí Cl2 và dung dịch NaOH.
Số cặp chất xảy ra phản ứng hoá học ở nhiệt độ thường là:
 Xem đáp án
Xem đáp án
Đáp án B.
Các cặp 2,3,5
H2S + Pb(NO3)2 →PbS + 2HNO3
2H2S + SO2 →3S + 2H2O
Cl2 + 2NaOH→ NaCl + NaClO + H2O
Câu 13:
21/07/2024Tiến hành các thí nghiệm sau
(1) O3 tác dụng với dung dịch KI.
(2) axit HF tác dụng với SiO2.
(3) khí SO2 tác dụng với nước Cl2.
(4) KClO3 đun nóng, xúc tác MnO2.
(5) Cho H2S tác dụng với SO2.
Số thí nghiệm tạo ra đơn chất là:
 Xem đáp án
Xem đáp án
Đáp án A.
Các thí nghiệm 1,4,5.
O3 + 2KI + H2O → 2KOH + I2 + O2
2KClO3 2KCl + 3O2
2H2S + SO2 →3S + 2H2O
Câu 14:
22/07/2024Cho 11 gam hỗn hợp bột sắt và bột nhôm tác dụng với bột lưu huỳnh trong điều kiện không có không khí) thấy có 12,8 gam lưu huỳnh tham gia phản ứng. Khối lượng sắt có trong 11 gam hỗn hợp đầu là:
 Xem đáp án
Xem đáp án
nS = 0,4 (mol)
=> mhh = mFe + mAl
Bảo toàn electron:
2nFe+ 3nAl = 2nS
=> 56nFe + 27 nAl = 11 ;
2nFe + 3nAl = 2.0,4
=> nFe = 0,1, nAl = 0,2
=> mFe = 0,1.56 = 5,6 (gam)
Câu 15:
23/07/2024Cho hỗn hợp gồm Fe và FeS tác dụng với dung dịch HCl dư, thu được 2,464 lít hỗn hợp khí X (đktc). Cho hỗn hợp khí này qua dung dịch Pb(NO3)2 dư thu 23,9g kết tủa màu đen. Thể tích các khí trong hỗn hợp khí X là:
 Xem đáp án
Xem đáp án
Đáp án A
Câu 16:
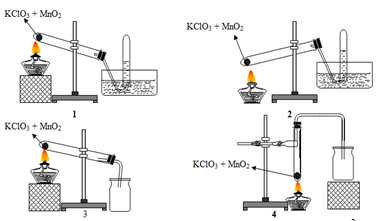
20/07/2024Cho các phản ứng sau:
(1) Na2SO3 + HCl → khí X
(2) KMnO4 khí Y
(3) Ca(HCO3)2 + HCl → khí Z
(4) FeS + HCl → khí T
Cho hỗn hợp chứa các khí trên đi qua bình đựng dung dịch NaOH dư. Số khí thoát ra khỏi bình là:
 Xem đáp án
Xem đáp án
Đáp án D.
Khí thoát ra khỏi bình là khí không phản ứng với NaOH.
Vậy khí thoát ra khỏi bình là O2.
Câu 17:
14/07/2024Hòa tan hỗn hợp gồm Fe và FeS vào dung dịch HCl dư, thu được 8,96 lít hỗn hợp khí (đktc). Cho hỗn hợp khí này đi qua dung dịch Pb(NO3)2 dư thì thu được 23,9 gam kết tủa đen. Khối lượng Fe trong hỗn hợp đầu là:
 Xem đáp án
Xem đáp án
Đáp án B
Câu 18:
23/07/2024Điều chế khí Y trong phòng thí nghiệm:
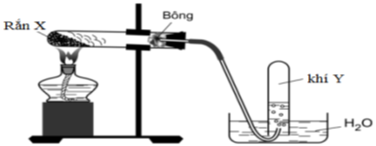
Cho các nhận định sau:
(a) Chất rắn X là KMnO4 thì khí Y là O2.
(b) Chất rắn X là NaNO3 thì khí Y là N2.
(c) Chất rắn X là KClO3 thì khí Y là Cl2.
(d) Chất rắn X là CaCO3 thì khí Y là O2.
Số nhận định đúng là:
 Xem đáp án
Xem đáp án
Đáp án C
Chỉ có nhận định a đúng.
Câu 19:
18/07/2024Điều chế oxi trong phòng thí nghiệm theo mô hình sau:
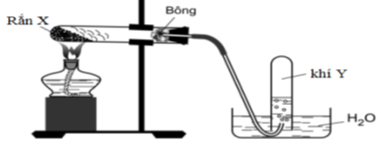
Nhận định nào sau đây là sai ?
 Xem đáp án
Xem đáp án
Đáp án B.
Câu 20:
09/07/2024Đun nóng 20 gam một hỗn hợp X gồm Fe và S trong điều kiện không có không khí thu được hỗn hợp rắn A. Hòa tan hỗn hợp rắn A vào dung dịch HCl thu được 6,72 lít (đktc) hỗn hợp khí Y. Thành phần phần trăm khối lượng Fe trong X là:
 Xem đáp án
Xem đáp án
Đáp án D.
Câu 21:
11/07/2024Nung nóng m gam PbS ngoài không khí sau một thời gian, thu được hỗn hợp rắn (có chứa một oxit) nặng 0,95m gam. Phần trăm khối lượng PbS đã bị đốt cháy là:
 Xem đáp án
Xem đáp án
Đáp án A.
0,95m (g) → hh (PbO và PbS dư) + SO2
Áp dụng ĐLBTKH ta có:
mO = m – 0,95m = 0,05m (g) → nO = 3,125.10-3 m (mol)
Ta có: nPbS phản ứng = nPbO = nO = 3,125.10-3 m (mol)
→ %PbS (đã bị đốt cháy) = = 74,69%
Câu 22:
03/07/2024Cho các phản ứng sau:
(1) SO2 + H2S → S + H2O
(2) SO2 + KMnO4 + H2O →MnSO4 + K2SO4 + H2SO4
(3) SO2 + Br2 + H2O → H2SO4 + HBr
(4) SO2 + Ca(OH)2 → Ca(HSO3)2
Số phản ứng mà SO2 đóng vai trò là chất khử là:
 Xem đáp án
Xem đáp án
Đáp án A.
Phản ứng 2, 3
Câu 23:
23/07/2024Từ 1,6 tấn quặng có chứa 60% FeS2, người ta có thể sản xuất được khối lượng axit sunfuric là bao nhiêu? (giả sử hiệu suất phản ứng là 100%)
 Xem đáp án
Xem đáp án
Đáp án D
Ta có sơ đồ:
Bài thi liên quan
-
125 câu trắc nghiệm Oxi - Lưu huỳnh nâng cao (P1)
-
25 câu hỏi
-
20 phút
-
-
125 câu trắc nghiệm Oxi - Lưu huỳnh nâng cao (P2)
-
25 câu hỏi
-
20 phút
-
-
125 câu trắc nghiệm Oxi - Lưu huỳnh nâng cao (P4)
-
25 câu hỏi
-
20 phút
-
-
125 câu trắc nghiệm Oxi - Lưu huỳnh nâng cao (P5)
-
25 câu hỏi
-
20 phút
-