Câu hỏi:
11/11/2024 176
Trong cùng một nhóm A, theo chiều tăng của điện tích hạt nhân, những yếu tố sẽ tăng dần là
Trong cùng một nhóm A, theo chiều tăng của điện tích hạt nhân, những yếu tố sẽ tăng dần là
A. bán kính nguyên tử và tính phi kim.
B. độ âm điện và tính phi kim.
B. độ âm điện và tính phi kim.
C. bán kính nguyên tử và tính kim loại.
D. độ âm điện và tính kim loại.
Trả lời:
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án đúng là: C
- Trong cùng một nhóm A, theo chiều tăng của điện tích hạt nhân, những yếu tố sẽ tăng dần là bán kính nguyên tử và tính kim loại.
Trong cùng một nhóm A, theo chiều tăng dần của điện tích hạt nhân, tính kim loại tăng dần, tính phi kim giảm dần, bán kính nguyên tử tăng dần, độ âm điện giảm dần.
→ C đúng.A,B,D sai.
* Bảng tuần hoàn các nguyên tố hóa học
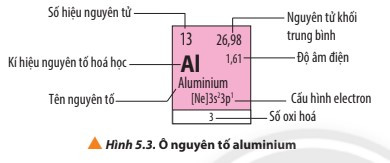
1. Ô nguyên tố
- Mỗi nguyên tố hóa học được xếp vào một ô trong bảng tuần hoàn các nguyên tố hóa học, gọi là ô nguyên tố.
- Số thứ tự của một ô nguyên tố bằng số hiệu nguyên tử của nguyên tố hóa học trong ô đó.
- Ví dụ: Ô nguyên tố aluminium
2. Chu kì
- Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng, gọi là chu kì.
- Số thứ tự của chu kì bằng số lớp electron của nguyên tử các nguyên tố trong chu kì.
- Bảng tuần hoàn gồm 7 chu kì:
+ Các chu kì 1, 2 và 3 là các chu kì nhỏ.
+ Các chu kì 4, 5, 6 và 7 là các chu kì lớn.

3. Nhóm
- Nhóm là tập hợp các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau (trừ nhóm VIIIB), do đó có tính chất hóa học gần giống nhau và được xếp theo cột.
- Số thứ tự của nhóm A bằng số electron ở lớp ngoài cùng của nguyên tử các nguyên tố trong nhóm.
- Bảng tuần hoàn hiện nay có 18 cột, chia thành 8 nhóm A (IA đến VIIIA) và 8 nhóm B (IB đến VIIIB). Mỗi cột tương ứng với một nhóm, riêng nhóm VIIIB có 3 cột.
-Electron hóa trịlà những electron có khả năng tham gia hình thành liên kết hóa học. Chúng thường nằm ởlớp ngoài cùnghoặccả ở phân lớp sát lớp ngoàicùng nếu phân lớp đó chưa bão hòa. Những nguyên tố có cùng số electron hóa trị thường có tính chất hóa học tương tự nhau.
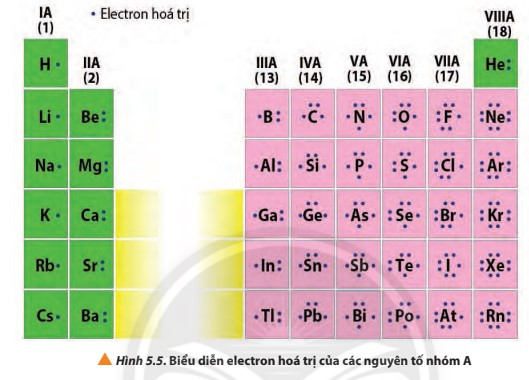
4. Phân loại nguyên tố dựa theo cấu hình electron và tính chất hóa học
- Các nguyên tố hóa học cũng có thể được chia thành các khối như sau:
+ Khối các nguyên tố s gồm các nguyên tố thuộc nhóm IA và nhóm IIA, có cấu hình electron: [Khí hiếm] ns1-2.
+ Khối các nguyên tố p gồm các nguyên tố thuộc nhóm IIIA đến VIIIA (trừ nguyên tố He), có cấu hình electron: [Khí hiếm] ns2np1-6.
+ Khối các nguyên tố d gồm các nguyên tố nhóm B, có cấu hình electron: [khí hiếm] (n – 1)d1-10ns1-2.
+ Khối các nguyên tố f gồm các nguyên tố xếp thành 2 hàng ở cuối bảng tuần hoàn, có cấu hình electron: [Khí hiếm] (n – 2)f0-14(n – 1)d0-2ns2 (trong đó n = 6 và n = 7)
- Dựa vào tính chất hóa học, người ta phân loại các nguyên tố hóa học thành:
+ Nguyên tố kim loại;
+ Nguyên tố phi kim;
+ Khí hiếm.
5. Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn
Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn:
+ Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
+ Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp vào cùng một chu kì.
+ Các nguyên tố có cùng số electron hóa trị trong nguyên tử được xếp vào cùng một nhóm, trừ nhóm VIIIB.
Xem thêm các bài viết liên quan,chi tiết khác:
Lý thuyết Hóa học 10 Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hóa học
Giải bài tập Hóa lớp 10 Bài 5: Cấu tạo bảng tuần hoàn các nguyên tố hóa học
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 1:
Nguyên tử Z có 7 neutron và 6 proton. Kí hiệu nguyên tử của Z là
Nguyên tử Z có 7 neutron và 6 proton. Kí hiệu nguyên tử của Z là
Câu 3:
Giải thích vì sao tetrachloromethane (CCl4) tuy là phân tử không cực nhưng có nhiệt độ sôi cao hơn trichloromethane (CHCl3) là phân tử có cực.
Giải thích vì sao tetrachloromethane (CCl4) tuy là phân tử không cực nhưng có nhiệt độ sôi cao hơn trichloromethane (CHCl3) là phân tử có cực.
Câu 5:
Nếu đường kính của nguyên tử khoảng 102 pm thì đường kính của hạt nhân khoảng
Câu 6:
Trong các nguyên tố nhóm A, đại lượng nào sau đây không biến đổi tuần hoàn?
Câu 7:
Công thức electron nào sau đây không đủ electron theo quy tắc octet?
Câu 8:
Mặc dù chlorine có độ âm điện là 3,16 xấp xỉ với nitrogen là 3,04 nhưng giữa các phân tử HCl không tạo được liên kết hydrogen với nhau, trong khi giữa các phân tử NH3 tạo được liên kết hydrogen với nhau, nguyên nhân là do
Mặc dù chlorine có độ âm điện là 3,16 xấp xỉ với nitrogen là 3,04 nhưng giữa các phân tử HCl không tạo được liên kết hydrogen với nhau, trong khi giữa các phân tử NH3 tạo được liên kết hydrogen với nhau, nguyên nhân là do
Câu 9:
Anion X– có cấu hình electron nguyên tử ở phân lớp ngoài cùng là 3p6.
a) Viết cấu hình electron của nguyên tử X. Cho biết X là nguyên tố kim loại hay phi kim?
Anion X– có cấu hình electron nguyên tử ở phân lớp ngoài cùng là 3p6.
a) Viết cấu hình electron của nguyên tử X. Cho biết X là nguyên tố kim loại hay phi kim?
Câu 12:
Khi hình thành liên kết hóa học, nguyên tử có số hiệu nào sau đây có xu hướng nhường 2 electron để đạt tới cấu hình electron bền vững theo quy tắc octet?
Câu 14:
Nguyên tố R có cấu hình electron: 1s22s22p4. Công thức hợp chất oxide ứng với hóa trị cao nhất của R là
Nguyên tố R có cấu hình electron: 1s22s22p4. Công thức hợp chất oxide ứng với hóa trị cao nhất của R là


