Câu hỏi:
22/07/2024 464
Tại nhiều làng nghề thủ công mĩ nghệ, sulfur dioxide được dùng là chất chống mốc cho các sản phẩm mây tre đan.
Trong một ngày, một làng nghề đốt cháy 20 kg sulfur để tạo thành sulfur dioxide.
a) Viết phương trình hoá học và tính thể tích khí SO2 (đkc) tối đa tạo ra?
b) Giả thiết có 20% lượng khí trên bay vào khí quyền và chuyển hoá hết thành H2SO4 trong nước mưa theo sơ đồ:
- Viết các phương trình hoá học theo sơ đồ trên.
- Tính thể tích nước mưa bị nhiễm acid nếu nồng độ H2SO4 trong nước mura là 1,25.10-5 M.
Tại nhiều làng nghề thủ công mĩ nghệ, sulfur dioxide được dùng là chất chống mốc cho các sản phẩm mây tre đan.
Trong một ngày, một làng nghề đốt cháy 20 kg sulfur để tạo thành sulfur dioxide.
a) Viết phương trình hoá học và tính thể tích khí SO2 (đkc) tối đa tạo ra?
b) Giả thiết có 20% lượng khí trên bay vào khí quyền và chuyển hoá hết thành H2SO4 trong nước mưa theo sơ đồ:
- Viết các phương trình hoá học theo sơ đồ trên.
- Tính thể tích nước mưa bị nhiễm acid nếu nồng độ H2SO4 trong nước mura là 1,25.10-5 M.
Trả lời:
 Giải bởi Vietjack
Giải bởi Vietjack
a) S + O2 → SO2
Mol: 625 625
Thể tích khí SO2 (đkc) tối đa tạo ra là:
V = 24,79.625 = 15 493,75 (lit)
b) 2SO2 + O2 → 2SO3
Mol: 125 125
SO3 + H2O → H2SO4
Mol: 125 125
Vậy thể tích nước mưa bị nhiễm acid là:
a) S + O2 → SO2
Mol: 625 625
Thể tích khí SO2 (đkc) tối đa tạo ra là:
V = 24,79.625 = 15 493,75 (lit)
b) 2SO2 + O2 → 2SO3
Mol: 125 125
SO3 + H2O → H2SO4
Mol: 125 125
Vậy thể tích nước mưa bị nhiễm acid là:
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 1:
Cho các loại khoáng vật sau: blend, chalcopyrite, thạch cao, pyrite. Số khoáng vật có thành phần chính chứa muối sulfide là
A. 2.
B. 4 .
C. 1 .
D. 3 .
Cho các loại khoáng vật sau: blend, chalcopyrite, thạch cao, pyrite. Số khoáng vật có thành phần chính chứa muối sulfide là
A. 2.
B. 4 .
C. 1 .
D. 3 .
Câu 2:
Phản ứng chuyển hoá hydrogen sulfide trong khí thiên nhiên thành sulfur được thực hiện theo sơ đồ phản ứng:
Khối lượng sulfur tối đa tạo ra khi chuyển hoá 1000 m3 khí thiên nhiên (đkc) (chứa 5 mg H2S/m3) là
A. 10,0 g.
B. 5,0 g.
C. 7,06 g.
D. 100,0 g.
Phản ứng chuyển hoá hydrogen sulfide trong khí thiên nhiên thành sulfur được thực hiện theo sơ đồ phản ứng:
Khối lượng sulfur tối đa tạo ra khi chuyển hoá 1000 m3 khí thiên nhiên (đkc) (chứa 5 mg H2S/m3) là
A. 10,0 g.
B. 5,0 g.
C. 7,06 g.
D. 100,0 g.
Câu 3:
Sulfur và quặng pyrite sắt là các nguyên liệu chính trong công nghiệp sản xuất sulfuric acid.
Tại một nhà máy, cứ đốt cháy 1 tấn quặng pyrite sắt (chứa 84% khối lượng FeS2) bằng không khí, thu được tối đa V m3 khí SO2 (đkc). Giá trị của V là
A. 173,5.
B. 347,0.
C. 86,8.
D. 477,2.
Sulfur và quặng pyrite sắt là các nguyên liệu chính trong công nghiệp sản xuất sulfuric acid.
Tại một nhà máy, cứ đốt cháy 1 tấn quặng pyrite sắt (chứa 84% khối lượng FeS2) bằng không khí, thu được tối đa V m3 khí SO2 (đkc). Giá trị của V là
A. 173,5.
B. 347,0.
C. 86,8.
D. 477,2.
Câu 4:
Xét phản ứng giữa sulfur và hydrogen ở điều kiện chuẩn:
Nhiệt tạo thành của H2S(g) là
A. -20,6 kJ/mol.
B. -41,2 kJ/mol.
C. 41,2 kJ/mol.
D. 20,6 kJ/mol.
Xét phản ứng giữa sulfur và hydrogen ở điều kiện chuẩn:
Nhiệt tạo thành của H2S(g) là
A. -20,6 kJ/mol.
B. -41,2 kJ/mol.
C. 41,2 kJ/mol.
D. 20,6 kJ/mol.
Câu 5:
Dẫn khí SO2 vào 100 mL dung dịch KMnO4 0,02 M đến khi mất màu tím theo sơ đồ phản ứng:
Thể tích khí SO2 (đkc) đã phản ứng là
A. 50 mL.
B. 248 mL.
C. 124 mL.
D. 100 mL.
Dẫn khí SO2 vào 100 mL dung dịch KMnO4 0,02 M đến khi mất màu tím theo sơ đồ phản ứng:
Thể tích khí SO2 (đkc) đã phản ứng là
A. 50 mL.
B. 248 mL.
C. 124 mL.
D. 100 mL.
Câu 6:
Xét phản ứng giữa NO2 và SO2 trong không khí ô nhiễm sulfur dioxide:
Tính biến thiên enthalpy của phản ứng và cho biết phản ứng trên là toả nhiệt hay thu nhiệt. (Biết nhiệt tạo thành của NO2(g), SO2(g), NO(g) và SO3(g) lần lượt là 33,2 kJ/mol, -296,8 kJ/mol, 91,3 kJ/mol và -395,7 kJ/mol.
Xét phản ứng giữa NO2 và SO2 trong không khí ô nhiễm sulfur dioxide:
Tính biến thiên enthalpy của phản ứng và cho biết phản ứng trên là toả nhiệt hay thu nhiệt. (Biết nhiệt tạo thành của NO2(g), SO2(g), NO(g) và SO3(g) lần lượt là 33,2 kJ/mol, -296,8 kJ/mol, 91,3 kJ/mol và -395,7 kJ/mol.
Câu 7:
Sự phụ thuộc của độ tan khí sulfur dioxide trong nước vào nhiệt độ được mô tả ở đồ thị bên.
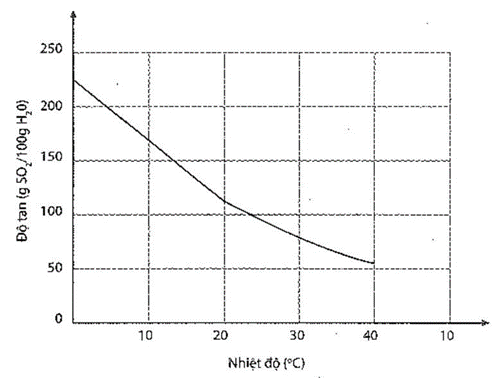
Sự phụ thuộc của độ tan khí sulfur dioxide vào nhiệt độ.
Dựa vào đồ thị, hãy ước tính:
a) Độ tan của sulfur dioxide ở 20oC. Nhận xét về tính tan của sulfur dioxide ở nhiệt độ này.
b) Nồng độ phần trăm của dung dịch sulfur dioxide bão hoà ở 20oC.
c) Nhiệt độ tại đó độ tan của khí sulfur dioxide là 10 g trong 100 g nước.
Sự phụ thuộc của độ tan khí sulfur dioxide trong nước vào nhiệt độ được mô tả ở đồ thị bên.

Sự phụ thuộc của độ tan khí sulfur dioxide vào nhiệt độ.
Dựa vào đồ thị, hãy ước tính:
a) Độ tan của sulfur dioxide ở 20oC. Nhận xét về tính tan của sulfur dioxide ở nhiệt độ này.
b) Nồng độ phần trăm của dung dịch sulfur dioxide bão hoà ở 20oC.
c) Nhiệt độ tại đó độ tan của khí sulfur dioxide là 10 g trong 100 g nước.
Câu 8:
Hỗn hợp X gồm SO2 và O2 có tỉ khối so với H2 bằng 24. Nung nóng X trong bình kín chứa xúc tác V2O5, thu được hỗn hợp khí Y có tỉ khối so với H2 bằng 30. Viết phương trình hoá học và tính hiệu suất của phản ứng oxi hoá SO2 thành SO3.
Hỗn hợp X gồm SO2 và O2 có tỉ khối so với H2 bằng 24. Nung nóng X trong bình kín chứa xúc tác V2O5, thu được hỗn hợp khí Y có tỉ khối so với H2 bằng 30. Viết phương trình hoá học và tính hiệu suất của phản ứng oxi hoá SO2 thành SO3.
Câu 9:
Phản ứng oxi hoá SO2 là giai đoạn then chốt trong quá trình sản xuất H2SO4 :
a) Viết biểu thức tính hằng số cân bằng KC của phản ứng.
b) Hãy cho biết phản ứng trên là toả nhiệt hay thu nhiệt.
c) Trong thực tế, phản ứng được thực hiện ở khoảng 450oC. Tại sao không thực hiện phản ứng ở 25oC hoặc 600oC ?
Phản ứng oxi hoá SO2 là giai đoạn then chốt trong quá trình sản xuất H2SO4 :
a) Viết biểu thức tính hằng số cân bằng KC của phản ứng.
b) Hãy cho biết phản ứng trên là toả nhiệt hay thu nhiệt.
c) Trong thực tế, phản ứng được thực hiện ở khoảng 450oC. Tại sao không thực hiện phản ứng ở 25oC hoặc 600oC ?
Câu 10:
Sulfur đóng vai trò chất khử khi tác dụng với đơn chất nào sau đây?
A. Fe.
B. O2.
C. H2.
D. Hg.
Sulfur đóng vai trò chất khử khi tác dụng với đơn chất nào sau đây?
A. Fe.
B. O2.
C. H2.
D. Hg.
Câu 11:
Ở điều kiện thích hợp, sulfur dioxide đóng vai trò là chất oxi hoá khi tham gia phản ứng với chất nào sau đây?
A. NO2.
B. H2S.
C. NaOH.
D. Ca(OH)2.
Ở điều kiện thích hợp, sulfur dioxide đóng vai trò là chất oxi hoá khi tham gia phản ứng với chất nào sau đây?
A. NO2.
B. H2S.
C. NaOH.
D. Ca(OH)2.
Câu 12:
Ở điều kiện thường, sulfur tồn tại ở dạng tinh thể, được tạo nên từ các phân tử sulfur. Số nguyên tử trong mỗi phân tử sulfur là
A. 2.
B. 4.
C. 6.
D. 8.
Ở điều kiện thường, sulfur tồn tại ở dạng tinh thể, được tạo nên từ các phân tử sulfur. Số nguyên tử trong mỗi phân tử sulfur là
A. 2.
B. 4.
C. 6.
D. 8.
Câu 13:
Trong công nghiệp, phần lớn sulfur đơn chất sau khi khai thác ở các mỏ được dùng làm nguyên liệu để
A. lưu hoá cao su tự nhiên.
B. sản xuất sulfuric acid.
C. điều chế thuốc bảo vệ thực vật.
D. bào chế thuốc đông  .
.
Trong công nghiệp, phần lớn sulfur đơn chất sau khi khai thác ở các mỏ được dùng làm nguyên liệu để
A. lưu hoá cao su tự nhiên.
B. sản xuất sulfuric acid.
C. điều chế thuốc bảo vệ thực vật.
D. bào chế thuốc đông ![]() .
.
Câu 14:
Trong số các chất khí: SO2, CO2, O2, N2 khí tan tốt trong nước ở điều kiện thường là
A. O2.
B. CO2.
C. SO2.
D. N2.
Trong số các chất khí: SO2, CO2, O2, N2 khí tan tốt trong nước ở điều kiện thường là
A. O2.
B. CO2.
C. SO2.
D. N2.
Câu 15:
Sau khi điều chế, khí SO2 có lẫn hơi nưởc được dẫn qua bình làm khô chứa các hạt chất rắn T rồi thu vào bình chứa theo hình vẽ sau:
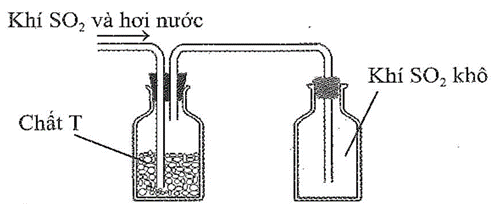
Chất T có thể là
A. KOH.
B. NaOH.
C. CaO.
D. P2O5.
Sau khi điều chế, khí SO2 có lẫn hơi nưởc được dẫn qua bình làm khô chứa các hạt chất rắn T rồi thu vào bình chứa theo hình vẽ sau:

Chất T có thể là
A. KOH.
B. NaOH.
C. CaO.
D. P2O5.


