Câu hỏi:
20/07/2024 1,850
Sử dụng cửa sổ Open – local của phần mềm Yenka nghiên cứu về mưa acid (theo hình hướng dẫn sau). Rút ra kết luận từ kết quả thí nghiệm.
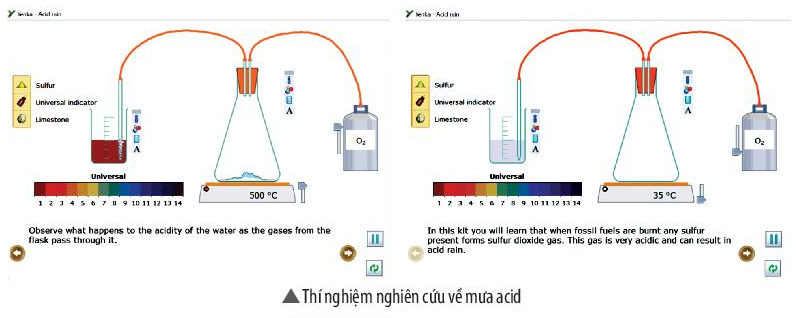
Sử dụng cửa sổ Open – local của phần mềm Yenka nghiên cứu về mưa acid (theo hình hướng dẫn sau). Rút ra kết luận từ kết quả thí nghiệm.

Trả lời:
 Giải bởi Vietjack
Giải bởi Vietjack
Bước 1: Nhấp chuột vào thể Open – local, chọn Acids, Bases and Salts → Acid rain, mô phỏng đã được thiết kế xuất hiện ở màn hình.
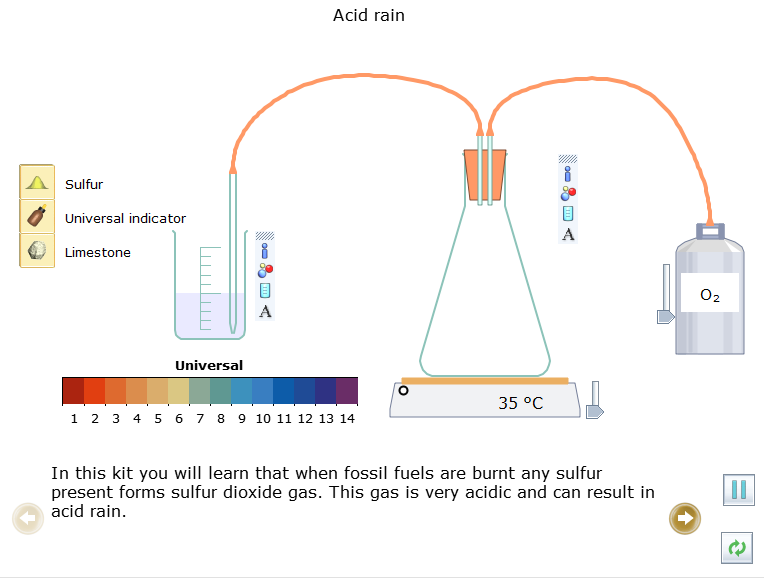
Trong thí nghiệm này em sẽ được hiểu rằng khi nhiên liệu hóa thạch bị đốt cháy thì sulfur (lưu huỳnh) sẽ chuyển thành khí sulfur dioxide (SO2). Khí này có tính acid rất cao và có thể dẫn đến mưa acid.
Bước 2: Nhấp chuột vào Next page  để thực hiện theo hướng dẫn.
để thực hiện theo hướng dẫn.
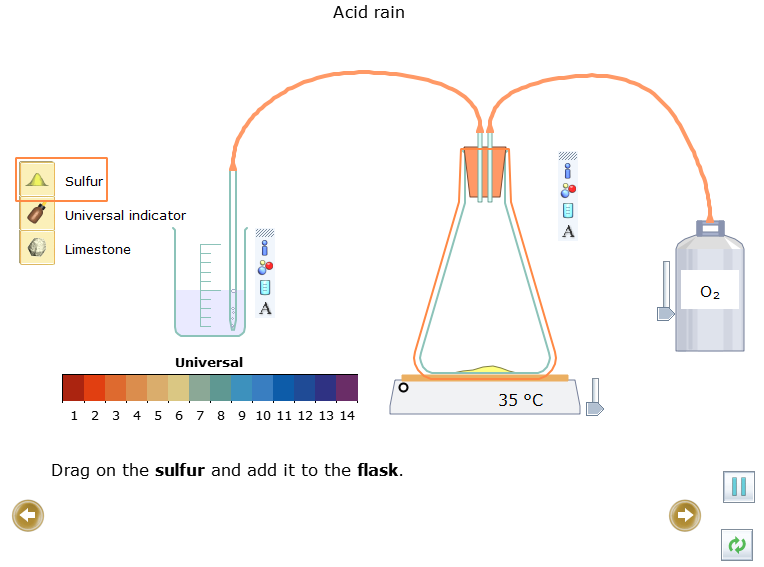
- Kéo Sulfur  rồi thêm vào bình
rồi thêm vào bình
- Kéo  (chỉ thị vạn năng) và thêm nó vào nước trong cốc.
(chỉ thị vạn năng) và thêm nó vào nước trong cốc.
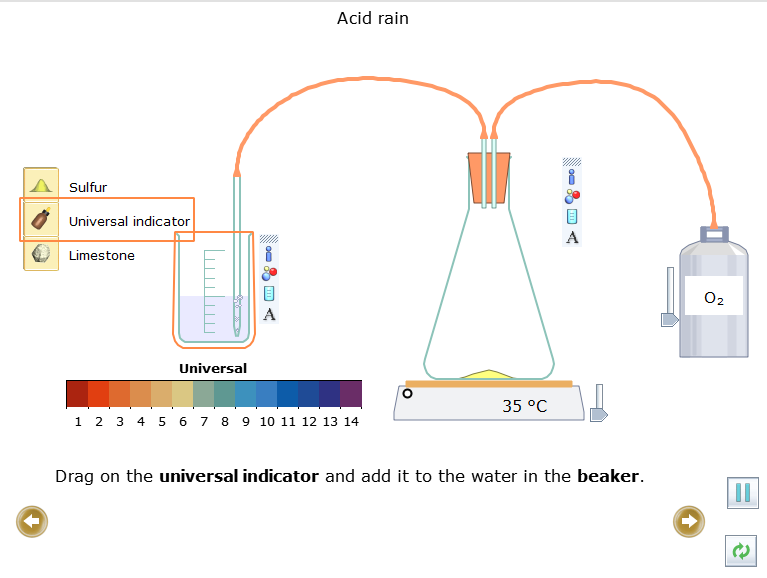
- Bật bình khí oxygen bằng cách kéo thanh trượt lên trên
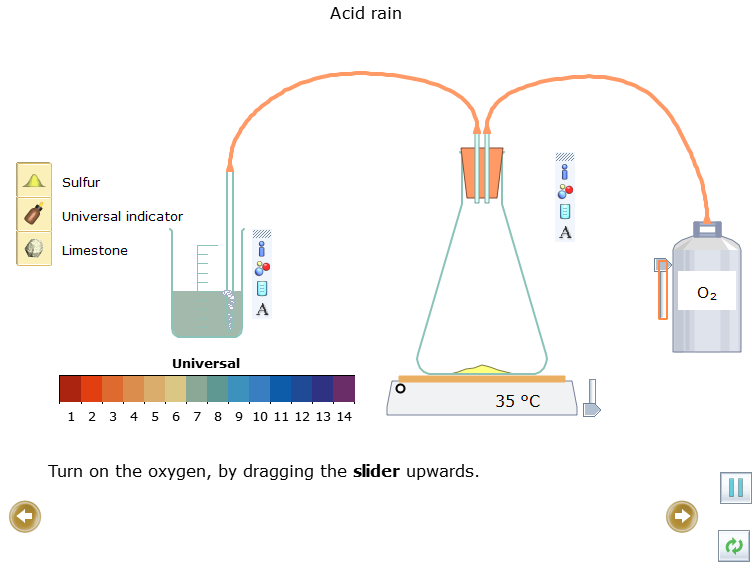
- Kéo tay cầm của thanh trượt trên bếp điện lên trên, cho đến khi sulfur bắt đầu đốt cháy.
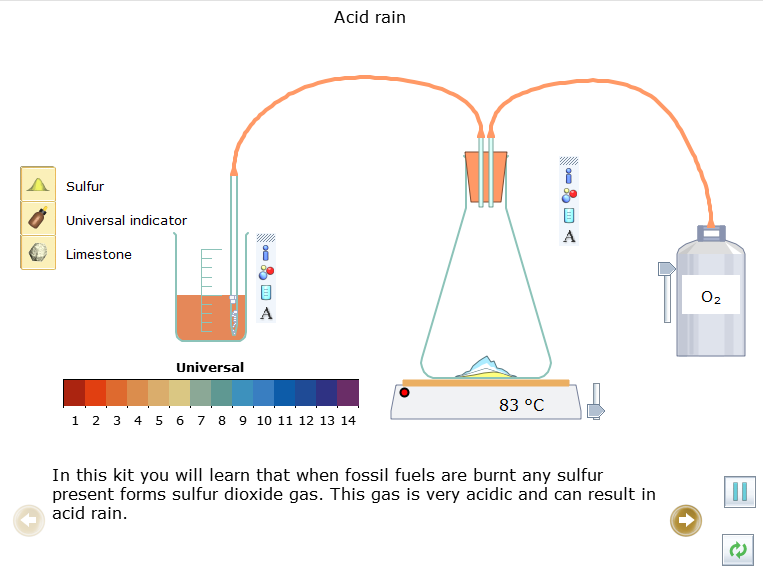
- Quan sát điều gì xảy ra với tính acid của nước khi các khí từ bình đi qua nó.
- Kéo đá vôi  vào cốc, quan sát hiện tượng xảy ra.
vào cốc, quan sát hiện tượng xảy ra.
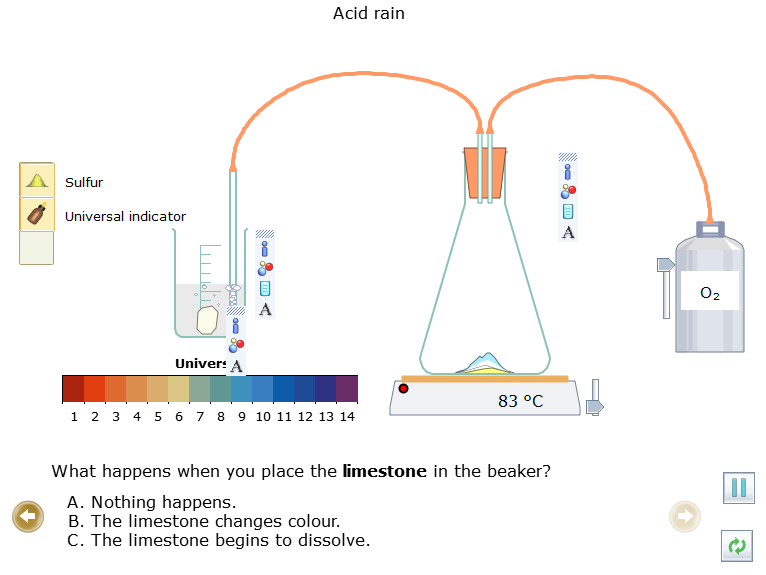
Bước 3: Ghi lại kết quả thí nghiệm và nhận xét
- Kết quả thí nghiệm:
+ Sulfur cháy trong oxygen với ngọn lửa màu xanh sáng.
+ Có khí thoát ra được dẫn vào cốc nước.
+ Khí này làm dung dịch trong cốc chuyển thành màu đỏ nhạt
+ Cho đá vôi vào dung dịch trong cốc thấy đá vôi tan, dung dịch từ màu đỏ chuyển thành không màu. Có khí thoát ra từ cốc.
- Nhận xét:
+ Sulfur cháy trong oxygen mãnh liệt với ngọn lửa màu xanh sáng tạo khí sulfur dioxide. Phương trình hóa học:
S(s) + O2(g) SO2(g)
+ Khí SO2 tan trong nước tạo dung dịch làm chỉ thị chuyển thành màu đỏ nhạt. Do có SO2 phản ứng với nước tạo H2SO3. H2SO3 có tính acid.
SO2 + H2O H2SO3
+ Cho đá vôi vào cốc có khí thoát ra từ cốc do có phản ứng:
CaCO3 + H2SO3 → CaSO3↓ + H2O + CO2↑
Acid phản ứng hết tạo môi trường trung tính.
Bước 1: Nhấp chuột vào thể Open – local, chọn Acids, Bases and Salts → Acid rain, mô phỏng đã được thiết kế xuất hiện ở màn hình.

Trong thí nghiệm này em sẽ được hiểu rằng khi nhiên liệu hóa thạch bị đốt cháy thì sulfur (lưu huỳnh) sẽ chuyển thành khí sulfur dioxide (SO2). Khí này có tính acid rất cao và có thể dẫn đến mưa acid.
Bước 2: Nhấp chuột vào Next page  để thực hiện theo hướng dẫn.
để thực hiện theo hướng dẫn.
- Kéo Sulfur ![]() rồi thêm vào bình
rồi thêm vào bình

- Kéo ![]() (chỉ thị vạn năng) và thêm nó vào nước trong cốc.
(chỉ thị vạn năng) và thêm nó vào nước trong cốc.

- Bật bình khí oxygen bằng cách kéo thanh trượt lên trên

- Kéo tay cầm của thanh trượt trên bếp điện lên trên, cho đến khi sulfur bắt đầu đốt cháy.

- Quan sát điều gì xảy ra với tính acid của nước khi các khí từ bình đi qua nó.
- Kéo đá vôi ![]() vào cốc, quan sát hiện tượng xảy ra.
vào cốc, quan sát hiện tượng xảy ra.

Bước 3: Ghi lại kết quả thí nghiệm và nhận xét
- Kết quả thí nghiệm:
+ Sulfur cháy trong oxygen với ngọn lửa màu xanh sáng.
+ Có khí thoát ra được dẫn vào cốc nước.
+ Khí này làm dung dịch trong cốc chuyển thành màu đỏ nhạt
+ Cho đá vôi vào dung dịch trong cốc thấy đá vôi tan, dung dịch từ màu đỏ chuyển thành không màu. Có khí thoát ra từ cốc.
- Nhận xét:
+ Sulfur cháy trong oxygen mãnh liệt với ngọn lửa màu xanh sáng tạo khí sulfur dioxide. Phương trình hóa học:
S(s) + O2(g) SO2(g)
+ Khí SO2 tan trong nước tạo dung dịch làm chỉ thị chuyển thành màu đỏ nhạt. Do có SO2 phản ứng với nước tạo H2SO3. H2SO3 có tính acid.
SO2 + H2O H2SO3
+ Cho đá vôi vào cốc có khí thoát ra từ cốc do có phản ứng:
CaCO3 + H2SO3 → CaSO3↓ + H2O + CO2↑
Acid phản ứng hết tạo môi trường trung tính.
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 1:
Sử dụng thẻ New để mô phỏng thí nghiệm copper(II) oxide tác dụng với 10 mL dung dịch hydrochloric acid 1 M.
Câu 2:
Sử dụng thể Open – local của phần mềm Yenka, thực hiện thí nghiệm ảnh hưởng của nhiệt độ lên tốc độ phản ứng “Temperature and rate”. Phân tích là lí giải kết quả của thí nghiệm.
Sử dụng thể Open – local của phần mềm Yenka, thực hiện thí nghiệm ảnh hưởng của nhiệt độ lên tốc độ phản ứng “Temperature and rate”. Phân tích là lí giải kết quả của thí nghiệm.
Câu 3:
Hãy thiết kế thí nghiệm (thẻ New): Phản ứng của dung dịch iron(II) chloride 1M (FeCl2) với dung dịch potassium hydroxide 1 M (KOH).
a) Ghi rõ các bước chuẩn bị hóa chất, dụng cụ, cách tiến hành thí nghiệm.
b) Nêu hiện tượng xảy ra và giải thích.
Hãy thiết kế thí nghiệm (thẻ New): Phản ứng của dung dịch iron(II) chloride 1M (FeCl2) với dung dịch potassium hydroxide 1 M (KOH).
a) Ghi rõ các bước chuẩn bị hóa chất, dụng cụ, cách tiến hành thí nghiệm.
b) Nêu hiện tượng xảy ra và giải thích.
Câu 4:
Sử dụng thẻ Open – local để mô phỏng thí nghiệm “Acid and base”. Phân tích và lí giải kết quả của thí nghiệm.
Sử dụng thẻ Open – local để mô phỏng thí nghiệm “Acid and base”. Phân tích và lí giải kết quả của thí nghiệm.
Câu 5:
Chọn hóa chất, dụng cụ và thực hiện thí nghiệm điều chế khi sulfur dioxide từ sulfur và oxygen.
Chọn hóa chất, dụng cụ và thực hiện thí nghiệm điều chế khi sulfur dioxide từ sulfur và oxygen.
Câu 7:
Thực hành thí nghiệm “Hình dạng phân tử” bằng phần mềm PhET. Rút ra kết luận từ kết quả thu được.
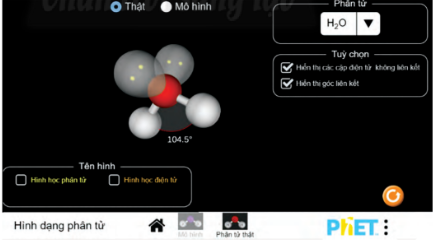
Thực hành thí nghiệm “Hình dạng phân tử” bằng phần mềm PhET. Rút ra kết luận từ kết quả thu được.

Câu 8:
Thực hành thí nghiệm “Dung dịch acid-base” bằng phần mềm PhET.
a) Hiển thị các dung dịch dưới dạng phân tử hoặc đồ thị.
b) Thực hiện thí nghiệm với các dụng cụ khác nhau được cung cấp trong mô phỏng.
c) Ghi lại kết quả của thí nghiệm.
d) Nhận xét về giá trị pH của dung dịch acid – base.
Thực hành thí nghiệm “Dung dịch acid-base” bằng phần mềm PhET.
a) Hiển thị các dung dịch dưới dạng phân tử hoặc đồ thị.
b) Thực hiện thí nghiệm với các dụng cụ khác nhau được cung cấp trong mô phỏng.
c) Ghi lại kết quả của thí nghiệm.
d) Nhận xét về giá trị pH của dung dịch acid – base.
Câu 9:
Từ giao diện của phần mềm (Hình 9.1), nêu những thành phần chính của các vùng trên giao diện phần mềm. Kho các bài thí nghiệm (open – online hay open – local) có vai trò gì cho người sử dụng?
Từ giao diện của phần mềm (Hình 9.1), nêu những thành phần chính của các vùng trên giao diện phần mềm. Kho các bài thí nghiệm (open – online hay open – local) có vai trò gì cho người sử dụng?
Câu 10:
Từ kết quả thí nghiệm “Surface area and rate” (Hình 9.5), hãy cho biết:
a) Mục đích sử dụng các quả bóng có màu khác nhau trong thí nghiệm?
b) Tốc độ thoát khí ở ống nghiệm nào nhanh nhất, ở ống nghiệm nào chậm nhất?
c) Diện tích bề mặt ảnh hưởng như thế nào đến tốc độ phản ứng?
Từ kết quả thí nghiệm “Surface area and rate” (Hình 9.5), hãy cho biết:
a) Mục đích sử dụng các quả bóng có màu khác nhau trong thí nghiệm?
b) Tốc độ thoát khí ở ống nghiệm nào nhanh nhất, ở ống nghiệm nào chậm nhất?
c) Diện tích bề mặt ảnh hưởng như thế nào đến tốc độ phản ứng?
Câu 11:
Từ các bước sử dụng thẻ Open – local, hãy thực hiện mô phỏng thí nghiệm “Định nghĩa tốc độ phản ứng” (Definition of reaction rate) trong mục “Tốc độ phản ứng” (Reaction Rates).
Câu 12:
Thí nghiệm hóa học có vai trò quan trọng đối với quá trình nhận thức và phát triển năng lực trong dạy và học môn Hóa học. Khi thiếu phương tiện, điều kiện thí nghiệm không đảm bảo hay thí nghiệm quá độc hại, tốn kém hoặc mất nhiều thời gian, chúng ta có thể thực hiện thí nghiệm hóa học ảo trên máy tính.
Những phần mềm nào có thể hỗ trợ thí nghiệm ảo trong học tập hóa học? Thực hiện thí nghiệm hóa học ảo như thế nào?

Thí nghiệm hóa học có vai trò quan trọng đối với quá trình nhận thức và phát triển năng lực trong dạy và học môn Hóa học. Khi thiếu phương tiện, điều kiện thí nghiệm không đảm bảo hay thí nghiệm quá độc hại, tốn kém hoặc mất nhiều thời gian, chúng ta có thể thực hiện thí nghiệm hóa học ảo trên máy tính.
Những phần mềm nào có thể hỗ trợ thí nghiệm ảo trong học tập hóa học? Thực hiện thí nghiệm hóa học ảo như thế nào?



