Câu hỏi:
11/11/2024 184Chọn đáp án đúng nhất.
Trong một nhóm A, bán kính nguyên tử của các nguyên tố
A. tăng theo chiều tăng của điện tích hạt nhân
B. tăng theo chiều tăng tính axit của các oxit và hiđroxit tương ứng
C. tăng theo chiều tăng của độ âm điện
D. tăng theo chiều tăng của năng lượng ion hóa thứ nhất I1
Trả lời:
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án đúng là : A
- Trong một nhóm A, bán kính nguyên tử của các nguyên tố tăng theo chiều tăng của điện tích hạt nhân.
+ Số lớp electron tăng: Khi đi xuống một nhóm (từ trên xuống), các nguyên tố có thêm lớp electron, khiến bán kính nguyên tử tăng lên dù điện tích hạt nhân cũng tăng. Mỗi lớp electron mới làm cho khoảng cách từ hạt nhân đến electron ngoài cùng lớn hơn.
+ Hiệu ứng chắn: Các lớp electron bên trong có tác dụng chắn, làm giảm lực hút của hạt nhân đối với các electron ở lớp ngoài cùng. Do đó, dù điện tích hạt nhân tăng, nhưng hiệu ứng chắn tăng dần khiến bán kính nguyên tử vẫn lớn hơn.
Vì vậy, trong một nhóm A, bán kính nguyên tử tăng khi đi từ trên xuống dưới cùng với sự tăng điện tích hạt nhân.
→ A đúng.B,C,D sai.
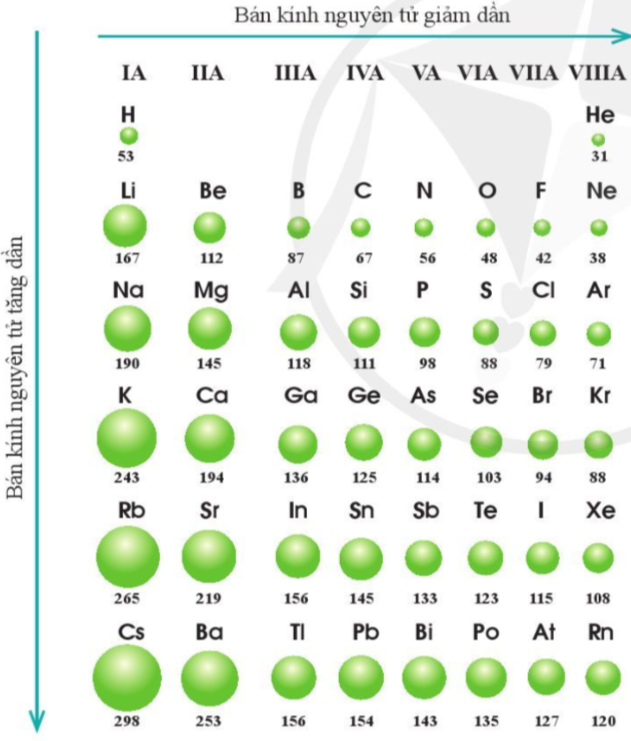
* Xu hướng biến đổi bán kính nguyên tử
1. Trong một chu kì
- Quy luật chung đối với các nguyên tố nhóm A: Trong một chu kì, theo chiều tăng dần điện tích hạt nhân, bán kính các nguyên tử có xu hướng giảm dần.
- Giải thích: Nguyên tử các nguyên tố trong cùng chu kì có cùng số lớp electron. Từ trái sang phải, điện tích hạt nhân nguyên tử tăng dần nên hạt nhân sẽ hút electron lớp ngoài cùng mạnh hơn, làm cho bán kính nguyên tử giảm.
Lưu ý: Bán kính nguyên tử là khoảng cách từ hạt nhân đến electron ở lớp vỏ ngoài cùng.
2. Trong một nhóm A
- Quy luật chung đối với các nguyên tố nhóm A: Trong một nhóm, theo chiều tăng dần điện tích hạt nhân, bán kính các nguyên tử có xu hướng tăng dần.
- Giải thích: Trong một nhóm A, theo chiều từ trên xuống dưới, bán kính nguyên tử tăng dần, nguyên nhân chủ yếu là do số lớp electron tăng dần.
Ví dụ: Trong nhóm IIA, bán kính nguyên tử của các nguyên tố tăng dần theo thứ tự: Be, Mg, Ca, Sr, Ba.
II. Xu hướng biến đổi độ âm điện, tính kim loại và tính phi kim
1. Độ âm điện
- Độ âm điện (χ – đọc là khi) là đại lượng đặc trưng cho khả năng hút electron liên kết của nguyên tử.
Lưu ý: Electron hóa trị đã tham gia hình thành liên kết hóa học thì gọi là electron liên kết.
- Độ âm điện được sử dụng rộng rãi là độ âm điện theo Pauling. Theo đó nguyên tử có độ âm điện lớn nhất là fluorine, χ(F) = 3,98.
- Quy luật chung đối với các nguyên tố nhóm A:
+ Trong một chu kì, theo chiều tăng điện tích hạt nhân, độ âm điện của các nguyên tử nguyên tố có xu hướng tăng dần.
+ Trong một nhóm, theo chiều tăng điện tích hạt nhân, độ âm điện của các nguyên tử nguyên tố có xu hướng giảm dần.

- Độ âm điện phụ thuộc đồng thời vào hai yếu tố: điện tích hạt nhân và bán kính nguyên tử.
- Giải thích:
+ Trong một chu kì, từ trái sang phải theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử giảm dần nên khả năng hút cặp electron liên kết càng tăng, dẫn tới độ âm điện càng tăng.
+ Trong một nhóm, từ trên xuống dưới theo chiều tăng dần của điện tích hạt nhân, bán kính nguyên tử tăng lên nên lực hút của hạt nhân tới cặp electron liên kết giảm, dẫn tới độ âm điện giảm.
Chú ý: Theo biểu thức F=aZr2, lực hút F giảm theo r2 và tăng theo Z, nghĩa là ảnh hưởng của r lớn hơn của Z tới lực hút của hạt nhân với electron.
2. Tính kim loại và tính phi kim
- Tính kim loại đặc trưng bởi khả năng nhường electron của nguyên tử.
- Tính phi kim đặc trưng bởi khả năng nhận electron của nguyên tử.
- Quy luật chung đối với các nguyên tố nhóm A:
+ Trong một chu kì, theo chiều tăng điện tích hạt nhân, tính kim loại của các nguyên tố có xu hướng giảm dần, tính phi kim của các nguyên tố có xu hướng tăng dần.
+ Trong một nhóm, theo chiều tăng điện tích hạt nhân, tính kim loại của các nguyên tố có xu hướng tăng dần, tính phi kim của các nguyên tố có xu hướng giảm dần.
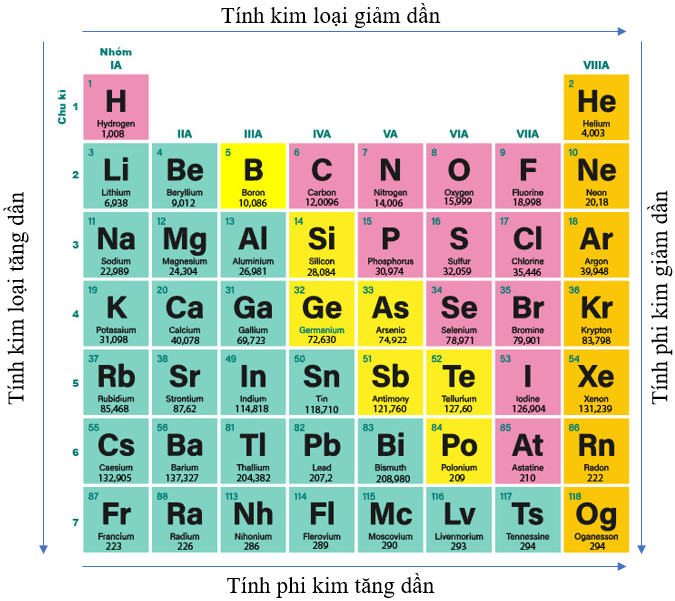
Hình 7.5. Quy luật biến đổi tính kim loại, tính phi kim
- Giải thích:
+ Trong một chu kì, từ trái sang phải, điện tích hạt nhân tăng dần, bán kính nguyên tử giảm dần nên lực hút của hạt nhân tới electron hóa trị tăng, làm giảm khả năng nhường electron, do đó tính kim loại của nguyên tố giảm.
+ Trong một nhóm A, mặc dù điện tích hạt nhân tăng dần nhưng do bán kính nguyên tử của các nguyên tố tăng nhanh, nên lực hút của hạt nhân tới electron hóa trị giảm dần, làm tăng khả năng nhường electron, do đó tính kim loại của nguyên tố tăng.
Lưu ý: Tính kim loại và tính phi kim luôn biến đổi ngược chiều nhau. Độ âm điện và tính phi kim của các nguyên tử của nguyên tố hóa học biến đổi cùng chiều trong một chu kì và trong một nhóm.
Xem thêm các bài viết liên quan,chi tiết khác:
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 1:
Trong một chu kì nhỏ, đi từ trái sang phải thì hoá trị cao nhất của các nguyên tố trong hợp chất với oxi
Câu 2:
Hợp chất ion G tạo nên từ các ion đơn nguyên tử M2+ và X2-. Tổng số hạt (nơtron, proton, electron) trong phân tử G là 84, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 28 hạt. Số hạt mang điện của ion X2- ít hơn số hạt mang điện của ion M2+ là 20 hạt. Vị trí của M trong bảng tuần hoàn là
Câu 4:
Trong một nhóm A, trừ nhóm VIIIA, theo chiều tăng của điện tích hạt nhân nguyên tử thì
Câu 5:
Trong chu kì 3, theo chiều tăng của điện tích hạt nhân thì
1) bán kính nguyên tử tăng. 2) độ âm điện giảm.
3) tính bazơ của oxit cao nhất và hiđroxit tương ứng giảm dần.
4) tính kim loại tăng dần. 5) tính phi kim giảm dần.
Số nhận định đúng là
Câu 6:
Các nguyên tố từ Li đến F, theo chiều tăng của điện tích hạt nhân thì
Câu 7:
Cho các nguyên tố: K (Z = 19), N (Z = 7), Si (Z = 14), Mg (Z = 12). Dãy gồm các nguyên tố được sắp xếp theo chiều giảm dần bán kính nguyên tử từ trái sang phải là
Câu 8:
Theo quy luật biến đổi tính chất của các nguyên tố trong bảng tuần hoàn thì
Câu 9:
Nguyên tố nào dưới đây có độ âm điện lớn nhất trong bảng tuần hoàn
Câu 11:
Trong các nguyên tố chu kỳ III: , năng lượng ion hóa thứ nhất của các nguyên tố trên tuân theo trật tự nào sau đây
Câu 13:
Chọn đáp án đúng nhất. Trong một chu kì, bán kính nguyên tử của các nguyên tố
Câu 14:
Các nguyên tố thuộc nhóm IA, theo chiều điện tích hạt nhân tăng dần thì
Câu 15:
Dãy gồm nguyên tử X và các ion đều có cấu hình electron phân lớp ngoài cùng là:


