Câu hỏi:
19/07/2024 116
Liên kết hydrogen không được hình thành giữa hai phân tử nào sau đây?
Liên kết hydrogen không được hình thành giữa hai phân tử nào sau đây?
A. 2 phân tử H2O.
A. 2 phân tử H2O.
B. 2 phân tử HF.
B. 2 phân tử HF.
C. 1 phân tử H2O và 1 phân tử CH4.
C. 1 phân tử H2O và 1 phân tử CH4.
D. 1 phân tử H2O và 1 phân tử NH3.
D. 1 phân tử H2O và 1 phân tử NH3.
Trả lời:
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án đúng là: C
Liên kết hydrogen là liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron riêng. Các nguyên tử có độ âm điện lớn thường gặp trong liên kết hydrogen là N, O, F.
Nguyên tử H của phân tử H2O không tạo được liên kết hydrogen với nguyên tử C của CH4 vì nguyên tử C của phân tử CH4 không còn cặp electron riêng.
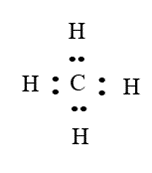
Đáp án đúng là: C
Liên kết hydrogen là liên kết yếu được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron riêng. Các nguyên tử có độ âm điện lớn thường gặp trong liên kết hydrogen là N, O, F.
Nguyên tử H của phân tử H2O không tạo được liên kết hydrogen với nguyên tử C của CH4 vì nguyên tử C của phân tử CH4 không còn cặp electron riêng.

CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 1:
Giải thích vì sao ở điều kiện thường nước ở thể lỏng, có nhiệt độ sôi cao (100oC).
Giải thích vì sao ở điều kiện thường nước ở thể lỏng, có nhiệt độ sôi cao (100oC).
Câu 4:
Liên kết hydrogen và tương tác van der Waals ảnh hưởng như thế nào đến nhiệt độ nóng chảy và nhiệt độ sôi của các chất?
Liên kết hydrogen và tương tác van der Waals ảnh hưởng như thế nào đến nhiệt độ nóng chảy và nhiệt độ sôi của các chất?
Câu 5:
Giải thích vì sao tính acid của HF yếu hơn rất nhiều so với các acid HCl, HBr, HI.
Giải thích vì sao tính acid của HF yếu hơn rất nhiều so với các acid HCl, HBr, HI.
Câu 6:
Các khí hiếm như neon, argon, … tồn tại dưới dạng các nguyên tử độc lập. Tuy nhiên ở nhiệt độ thấp, khí hiếm có thể hóa lỏng, đó là do tồn tại
Các khí hiếm như neon, argon, … tồn tại dưới dạng các nguyên tử độc lập. Tuy nhiên ở nhiệt độ thấp, khí hiếm có thể hóa lỏng, đó là do tồn tại
Câu 11:
Giải thích vì sao cùng là phân tử phân cực, ở nhiệt độ phòng, fluorine, chlorine là những chất khí còn bromine là chất lỏng?
Giải thích vì sao cùng là phân tử phân cực, ở nhiệt độ phòng, fluorine, chlorine là những chất khí còn bromine là chất lỏng?
Câu 12:
So với lực kiên kết ion, liên kết cộng hóa trị hay liên kết kim loại thì tương tác giữa các phân tử
So với lực kiên kết ion, liên kết cộng hóa trị hay liên kết kim loại thì tương tác giữa các phân tử


