Câu hỏi:
18/07/2024 109
Khi đun nóng chảy tinh thể NaCl, độ mất trật tự của các ion tăng hay giảm? Tại sao?
Khi đun nóng chảy tinh thể NaCl, độ mất trật tự của các ion tăng hay giảm? Tại sao?
Trả lời:
 Giải bởi Vietjack
Giải bởi Vietjack
Khi đun nóng chảy tinh thể NaCl, độ mất trật tự của các ion tăng vì muối ăn đã chuyển từ trạng thái tinh thể sang trạng thái lỏng.
Khi đun nóng chảy tinh thể NaCl, độ mất trật tự của các ion tăng vì muối ăn đã chuyển từ trạng thái tinh thể sang trạng thái lỏng.
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 1:
Tính của các phản ứng sau và cho biết ở điều kiện chuẩn các phản ứng có tự xảy ra hay không.
a) H2(g) + Cl2(g) → 2HCl(g)
= -184,6 kJ
b) CH4(g) + 2O2(g) → CO2(g) + 2H2O(l)
= -890,3 kJ
c) 2Na(s) + O2(g) → Na2O2(s)
= -510,9 kJ
Tính của các phản ứng sau và cho biết ở điều kiện chuẩn các phản ứng có tự xảy ra hay không.
a) H2(g) + Cl2(g) → 2HCl(g)
= -184,6 kJ
b) CH4(g) + 2O2(g) → CO2(g) + 2H2O(l)
= -890,3 kJ
c) 2Na(s) + O2(g) → Na2O2(s)
= -510,9 kJ
Câu 2:
Hãy đánh giá khả năng tự xảy ra của phản ứng sau ở nhiệt độ chuẩn:
2Al(s) + 3H2O(l) → Al2O3(s) + 3H2(g)
Biết rằng: = - 818,3 kJ, được tính theo số liệu cho trong Phụ lục 1. Từ kết quả này hãy đưa ra một số lí do giải thích cho việc vì sao các đồ vật bằng nhôm được sử dụng rất phổ biến.
Hãy đánh giá khả năng tự xảy ra của phản ứng sau ở nhiệt độ chuẩn:
2Al(s) + 3H2O(l) → Al2O3(s) + 3H2(g)
Biết rằng: = - 818,3 kJ, được tính theo số liệu cho trong Phụ lục 1. Từ kết quả này hãy đưa ra một số lí do giải thích cho việc vì sao các đồ vật bằng nhôm được sử dụng rất phổ biến.
Câu 3:
Tính của các phản ứng sau:
a) 2Ca(s) + O2(g) → 2CaO(s)
b) CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
c) NH3(g) + HCl(g) → NH4Cl(s)
Tính của các phản ứng sau:
a) 2Ca(s) + O2(g) → 2CaO(s)
b) CH4(g) + 2O2(g) → CO2(g) + 2H2O(g)
c) NH3(g) + HCl(g) → NH4Cl(s)
Câu 4:
Mặc dù phản ứng (3) có thể xảy ra ở nhiệt độ 848oC, nhưng trong thực tế người ta thường nung nóng CaCO3 tới nhiệt độ 1 000oC. Giải thích vì sao?
Mặc dù phản ứng (3) có thể xảy ra ở nhiệt độ 848oC, nhưng trong thực tế người ta thường nung nóng CaCO3 tới nhiệt độ 1 000oC. Giải thích vì sao?
Câu 5:
Hãy xác định nhiệt độ thấp nhất để phản ứng nhiệt phân NaHCO3 dưới đây diễn ra:
2NaHCO3(s) → Na2CO3(s) + H2O(l) + CO2(g)
Biết rằng: = 9,16 kJ, được tính theo số liệu cho trong Phụ lục 1. Giả sử biến thiên enthapy và biến thiên entropy của phản ứng không phụ thuộc vào nhiệt độ.
Hãy xác định nhiệt độ thấp nhất để phản ứng nhiệt phân NaHCO3 dưới đây diễn ra:
2NaHCO3(s) → Na2CO3(s) + H2O(l) + CO2(g)
Biết rằng: = 9,16 kJ, được tính theo số liệu cho trong Phụ lục 1. Giả sử biến thiên enthapy và biến thiên entropy của phản ứng không phụ thuộc vào nhiệt độ.
Câu 6:
Tính biến thiên entropy chuẩn cho phản ứng đốt cháy 1 mol CH3OH(l) bằng O2(g), thu được CO2(g) và H2O(g)
Tính biến thiên entropy chuẩn cho phản ứng đốt cháy 1 mol CH3OH(l) bằng O2(g), thu được CO2(g) và H2O(g)
Câu 7:
Để dự đoán khả năng tự xảy ra phản ứng cần sử dụng và . Giải thích.
Để dự đoán khả năng tự xảy ra phản ứng cần sử dụng và . Giải thích.
Câu 8:
Hãy xác định nhiệt độ sôi của CHCl3(l) ở 1 bar và so sánh với giá trị đo được từ thực nghiệm (61,2oC). Giả thiết biến thiên enthalpy và entropy của quá trình không thay đổi theo nhiệt độ.
Biết rằng:
(kJ mol-1)
(J mol-1K-1)
CHCl3(l)
-134,1
201,7
CHCl3(g)
-102,7
295,7
Hãy xác định nhiệt độ sôi của CHCl3(l) ở 1 bar và so sánh với giá trị đo được từ thực nghiệm (61,2oC). Giả thiết biến thiên enthalpy và entropy của quá trình không thay đổi theo nhiệt độ.
Biết rằng:
|
|
(kJ mol-1) |
(J mol-1K-1) |
|
CHCl3(l) |
-134,1 |
201,7 |
|
CHCl3(g) |
-102,7 |
295,7 |
Câu 9:
Cho phản ứng:
ZnCO3(s) → ZnO(s) + CO2(g)
Ở điều kiện chuẩn, phản ứng có tự xảy ra tại các nhiệt độ sau hay không?
a) 25oC
b) 500oC.
Biết rằng: = 710 kJ, = 174,8 J K-1. Giải sử biến thiên enthalpy và biến thiên entropy của phản ứng không phụ thuộc vào nhiệt độ.
Cho phản ứng:
ZnCO3(s) → ZnO(s) + CO2(g)
Ở điều kiện chuẩn, phản ứng có tự xảy ra tại các nhiệt độ sau hay không?
a) 25oC
b) 500oC.
Biết rằng: = 710 kJ, = 174,8 J K-1. Giải sử biến thiên enthalpy và biến thiên entropy của phản ứng không phụ thuộc vào nhiệt độ.
Câu 10:
Từ giá trị của phản ứng (2) ở nhiệt độ 298 K và 203 K, hãy cho biết ở nhiệt độ thấp hơn hay cao hơn thì phản ứng diễn ra thuận lợi hơn?
Từ giá trị của phản ứng (2) ở nhiệt độ 298 K và 203 K, hãy cho biết ở nhiệt độ thấp hơn hay cao hơn thì phản ứng diễn ra thuận lợi hơn?
Câu 12:
Thả một vài tinh thể patassium dichromate K2Cr2O7 màu cam đỏ vào nước (Hình 4.3). Entropy của quá trình hòa tan này tăng hay giảm? Giải thích.
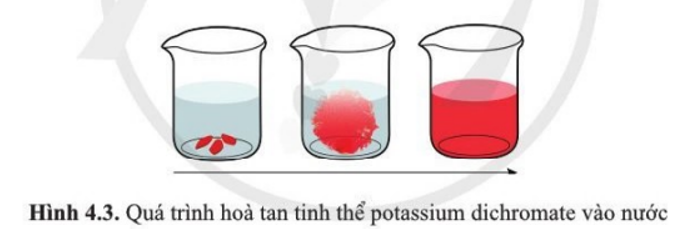
Thả một vài tinh thể patassium dichromate K2Cr2O7 màu cam đỏ vào nước (Hình 4.3). Entropy của quá trình hòa tan này tăng hay giảm? Giải thích.
Câu 13:
Ở điều kiện thường (coi là 25oC, 1 bar), có tự xảy ra quá trình sắt bị biến đổi thành Fe2O3(s) (có trong thành phần gỉ sắt) được không?
Ở điều kiện thường (coi là 25oC, 1 bar), có tự xảy ra quá trình sắt bị biến đổi thành Fe2O3(s) (có trong thành phần gỉ sắt) được không?
Câu 14:
Hình 4.1 dưới đây mô tả trật tự sắp xếp của các phân tử nước ở ba thể: rắn, lỏng và khí. Em hãy cho biết mức độ “mất trật tự” của hệ tăng hay giảm theo chiều từ nước đá tới hơi nước.
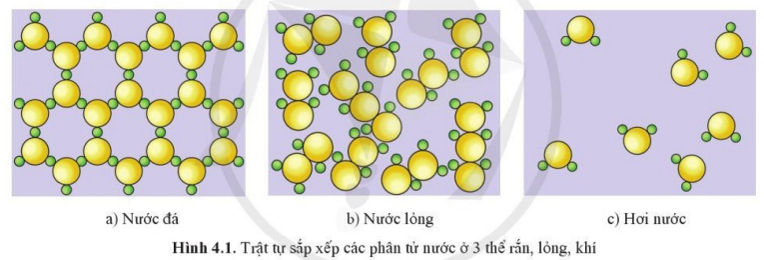
Hình 4.1 dưới đây mô tả trật tự sắp xếp của các phân tử nước ở ba thể: rắn, lỏng và khí. Em hãy cho biết mức độ “mất trật tự” của hệ tăng hay giảm theo chiều từ nước đá tới hơi nước.


