Câu hỏi:
21/07/2024 88
Cho phản ứng:
2SO2(g) + O2(g) → 2SO3(g)
Biết Ea = 314 kJ mol-1
a) Hãy so sánh tốc độ phản ứng ở 25oC và 450oC
b) Nếu sử dụng xúc tác là hỗn hợp V2O5, TiO2 thì năng lượng hoạt hóa của phản ứng là 84 kJ mol-1 . Hãy so sánh tốc độ phản ứng khi có và không có chất xúc tác ở nhiệt độ 450oC.
Cho phản ứng:
2SO2(g) + O2(g) → 2SO3(g)
Biết Ea = 314 kJ mol-1
a) Hãy so sánh tốc độ phản ứng ở 25oC và 450oC
b) Nếu sử dụng xúc tác là hỗn hợp V2O5, TiO2 thì năng lượng hoạt hóa của phản ứng là 84 kJ mol-1 . Hãy so sánh tốc độ phản ứng khi có và không có chất xúc tác ở nhiệt độ 450oC.
Trả lời:
 Giải bởi Vietjack
Giải bởi Vietjack
a) Theo phương trình Arrhenius ta có:
(1)
(2)
T1 = 25 + 273 = 298K
T2 = 450 + 273 = 723K
Chia vế hai phương trình (2) cho (1) ta được
= = 2,26.1032
Vậy tốc độ phản ứng tăng 2,26.1032 lần khi nhiệt độ tăng từ 25oC đến 450oC.
b) Áp dụng phương trình Arrhenius ta có:
(3)
(4)
Chia vế hai phương trình (4) cho (3), thu được: (5)
Thay số vào (5) ta được: = 4,14.1016
Vậy khi thêm chất xúc tác thì tốc độ phản ứng tăng 4,14.1016 lần.
a) Theo phương trình Arrhenius ta có:
(1)
(2)
T1 = 25 + 273 = 298K
T2 = 450 + 273 = 723K
Chia vế hai phương trình (2) cho (1) ta được
= = 2,26.1032
Vậy tốc độ phản ứng tăng 2,26.1032 lần khi nhiệt độ tăng từ 25oC đến 450oC.
b) Áp dụng phương trình Arrhenius ta có:
(3)
(4)
Chia vế hai phương trình (4) cho (3), thu được: (5)
Thay số vào (5) ta được: = 4,14.1016
Vậy khi thêm chất xúc tác thì tốc độ phản ứng tăng 4,14.1016 lần.
CÂU HỎI HOT CÙNG CHỦ ĐỀ
Câu 1:
Cho phản ứng
C2H4(g) + H2(g) → C2H6(g)
Năng lượng hoạt hóa của phản ứng khi có xúc tác Pd là 35 kJ mol-1 . Hãy so sánh sự thay đổi tốc độ phản ứng khi có xúc tác Pd ở nhiệt độ 300 K và 475 K.
Cho phản ứng
C2H4(g) + H2(g) → C2H6(g)
Năng lượng hoạt hóa của phản ứng khi có xúc tác Pd là 35 kJ mol-1 . Hãy so sánh sự thay đổi tốc độ phản ứng khi có xúc tác Pd ở nhiệt độ 300 K và 475 K.
Câu 2:
Hình 3.3 biểu diễn cùng một phản ứng nhưng có năng lượng hoạt hóa khác nhau.
a) Trường hợp ứng với năng lượng hoạt hóa nào thì phản ứng xảy ra với tốc độ lớn hơn?
b) Biến thiên enthalpy phản ứng (∆rH) trong trường hợp này là âm, nghĩa là thuận lợi (về enthalpy) cho phản ứng diễn ra. Nếu ∆rH rất âm nhưng phản ứng lại có Ea rất lớn thì phản ứng này có dễ dàng xảy ra không? Giải thích.
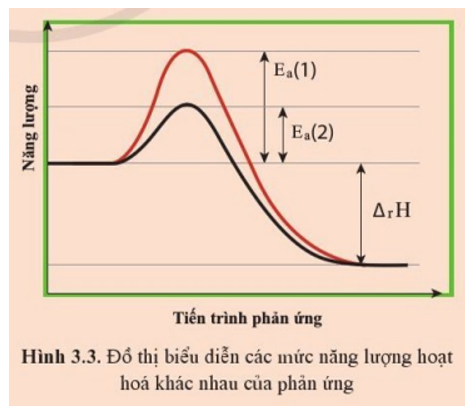
Hình 3.3 biểu diễn cùng một phản ứng nhưng có năng lượng hoạt hóa khác nhau.
a) Trường hợp ứng với năng lượng hoạt hóa nào thì phản ứng xảy ra với tốc độ lớn hơn?
b) Biến thiên enthalpy phản ứng (∆rH) trong trường hợp này là âm, nghĩa là thuận lợi (về enthalpy) cho phản ứng diễn ra. Nếu ∆rH rất âm nhưng phản ứng lại có Ea rất lớn thì phản ứng này có dễ dàng xảy ra không? Giải thích.
Câu 3:
Giả sử hai phản ứng hóa học khác nhau có cùng Ea, diễn ra ở cùng nhiệt độ. Vậy hằng số tốc độ k có luôn bằng nhau không?
Giả sử hai phản ứng hóa học khác nhau có cùng Ea, diễn ra ở cùng nhiệt độ. Vậy hằng số tốc độ k có luôn bằng nhau không?
Câu 4:
Phát biểu định luật tác dụng khối lượng về tốc độ của phản ứng hóa học.
Phát biểu định luật tác dụng khối lượng về tốc độ của phản ứng hóa học.
Câu 5:
Thực hiện hai thí nghiệm hòa tan đá vôi vào dung dịch HCl 1M ở cùng một nhiệt độ.
Thí nghiệm 1: Cho 0,5 gam đá vôi dạng bột bào 10 mL HCl 1 M.
Thí nghiệm 2: Cho 0,5 gam đá vôi dạng viên vào 10 mL HCl 1 M.
a) Tốc độ phản ứng ở thí nghiệm nào nhanh hơn? Giải thích.
b) Năng lượng hoạt hóa của hai phản ứng bằng nhau hai khác nhau?
Thực hiện hai thí nghiệm hòa tan đá vôi vào dung dịch HCl 1M ở cùng một nhiệt độ.
Thí nghiệm 1: Cho 0,5 gam đá vôi dạng bột bào 10 mL HCl 1 M.
Thí nghiệm 2: Cho 0,5 gam đá vôi dạng viên vào 10 mL HCl 1 M.
a) Tốc độ phản ứng ở thí nghiệm nào nhanh hơn? Giải thích.
b) Năng lượng hoạt hóa của hai phản ứng bằng nhau hai khác nhau?
Câu 6:
Hãy liên hệ kết quả ở ví dụ 2 với hệ số Van’t Hoff về sự thay đổi tốc độ phản ứng theo nhiệt độ
Hãy liên hệ kết quả ở ví dụ 2 với hệ số Van’t Hoff về sự thay đổi tốc độ phản ứng theo nhiệt độ
Câu 7:
Cho phản ứng:
2NO2(g) → 2NO(g) + O2(g)
So sánh tốc độ phân hủy NO2 ở nhiệt độ 25oC (nhiệt độ thường) và 800oC (nhiệt độ ống xả khí thải động cơ đốt trong). Biết Ea = 114 kJ mol-1
Cho phản ứng:
2NO2(g) → 2NO(g) + O2(g)
So sánh tốc độ phân hủy NO2 ở nhiệt độ 25oC (nhiệt độ thường) và 800oC (nhiệt độ ống xả khí thải động cơ đốt trong). Biết Ea = 114 kJ mol-1
Câu 8:
Nếu ở ví dụ 1, Ea (1) = 100 kJ mol-1 và Ea (2) = 150 kJ mol-1 thì tốc độ phản ứng thay đổi như thế nào?
Nếu ở ví dụ 1, Ea (1) = 100 kJ mol-1 và Ea (2) = 150 kJ mol-1 thì tốc độ phản ứng thay đổi như thế nào?
Câu 9:
Vì sao trong lĩnh vực sản xuất hóa chất, người ta thường sử dụng chất xúc tác? Kể tên một số quá trình sản xuất hóa chất và chất xúc tác được sử dụng mà em biết.
Vì sao trong lĩnh vực sản xuất hóa chất, người ta thường sử dụng chất xúc tác? Kể tên một số quá trình sản xuất hóa chất và chất xúc tác được sử dụng mà em biết.
Câu 10:
Các phản ứng tạo gỉ kim loại có thể xảy ra ngay ở điều kiện nhiệt độ phòng mà không cần đun nóng. Hãy dự đoán năng lượng hoạt hóa của phản ứng là thấp hay cao.
Các phản ứng tạo gỉ kim loại có thể xảy ra ngay ở điều kiện nhiệt độ phòng mà không cần đun nóng. Hãy dự đoán năng lượng hoạt hóa của phản ứng là thấp hay cao.
Câu 11:
Một phản ứng diễn ra ở một nhiệt độ không đổi, khi thêm chất xúc tác, tốc độ phản ứng tăng lên do năng lượng hoạt hóa bị thay đổi. Vậy chất xúc tác làm tăng hay giảm năng lượng hoạt hóa của phản ứng?
Một phản ứng diễn ra ở một nhiệt độ không đổi, khi thêm chất xúc tác, tốc độ phản ứng tăng lên do năng lượng hoạt hóa bị thay đổi. Vậy chất xúc tác làm tăng hay giảm năng lượng hoạt hóa của phản ứng?
Câu 12:
Nếu ở ví dụ 2, Ea = 50 kJ mol-1 thì tốc độ phản ứng thay đổi như thế nào?
Nếu ở ví dụ 2, Ea = 50 kJ mol-1 thì tốc độ phản ứng thay đổi như thế nào?
Câu 13:
Trong Hình 3.1, muốn lăn “hòn bi hóa học” sang phải theo chiều mũi tên màu xanh, hòn bi phải đi qua “hàng rào năng lượng” có chiều cao Ea. Những phát biểu nào sau đây là đúng?
(1) Hàng rào Ea càng cao thì hòn bi càng dễ lăn qua.
(2) Hàng rào Ea càng thấp thì hòn bi càng dễ lăn qua.
(3) Cần phải cung cấp năng lượng cho hòn bi thì quá trình lăn sang mới xảy ra.
(4) Hòn bi tự lăn sang phải mà không cần cung cấp thêm năng lượng.
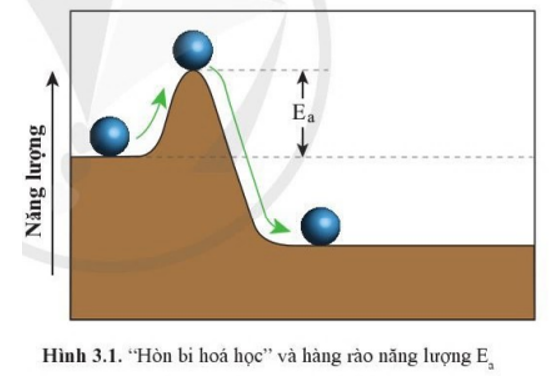
Trong Hình 3.1, muốn lăn “hòn bi hóa học” sang phải theo chiều mũi tên màu xanh, hòn bi phải đi qua “hàng rào năng lượng” có chiều cao Ea. Những phát biểu nào sau đây là đúng?
(1) Hàng rào Ea càng cao thì hòn bi càng dễ lăn qua.
(2) Hàng rào Ea càng thấp thì hòn bi càng dễ lăn qua.
(3) Cần phải cung cấp năng lượng cho hòn bi thì quá trình lăn sang mới xảy ra.
(4) Hòn bi tự lăn sang phải mà không cần cung cấp thêm năng lượng.


